Science et nature
Le Diable se Cache dans les Détails, Chapitre Un : Le Médecin qui a Refusé la Thalidomide
In this first chapter of a new five-part season of Lost Women of Science, we meet Frances Oldham Kelsey, a physician and pharmacologist who joined the U.S. Food and Drug Administration as a medical reviewer in 1960. Before the year was out, Kelsey found herself standing up to big pharma. It’s September 1960, and a
Frances Oldham Kelsey : Une Héroïne de la Médecine
Dans ce premier chapitre d’une nouvelle saison en cinq parties de « Femmes Oubliées de la Science », nous découvrons Frances Oldham Kelsey, une médecin et pharmacologue qui a rejoint la Food and Drug Administration (FDA) des États-Unis en tant qu’évaluatrice médicale en 1960. Avant la fin de l’année, Kelsey se retrouve à défier l’industrie pharmaceutique.
Un Début Prometteur
En septembre 1960, une demande d’autorisation de mise sur le marché d’un nouveau médicament arrive sur le bureau de Kelsey. Ce médicament, déjà commercialisé en Europe depuis trois ans, devait être approuvé rapidement par ses supérieurs. Il s’agit de Kevadon, dont le principe actif est le thalidomide. Cependant, l’œil aiguisé de Kelsey détecte des anomalies.
Une Révélation Alarmante
En 1962, Sherri Chessen, animatrice d’une émission pour enfants en Arizona, était entourée de jeunes tout au long de la journée. Elle était connue sous le nom de « Miss Sherri », animant une version locale de « Romper Room », une émission très populaire à l’époque. Sherri avait toujours eu un lien fort avec les enfants, ayant été conseillère de camp et animatrice de natation.
À cette époque, Sherri était également enceinte de son cinquième enfant, tout en s’occupant de ses quatre autres enfants, tous âgés de moins de 8 ans. Elle était ravie, bien que la nausée matinale soit particulièrement difficile cette fois-ci. Un jour, alors qu’elle feuilletait un journal, elle tomba sur un article troublant.
Un Danger Inconnu
L’article en question relatait des cas de milliers de bébés nés en Allemagne avec des membres manquants, parfois sans membres du tout, en raison d’un médicament pris par leurs mères pendant la grossesse : le thalidomide. Heureusement, le médicament n’avait jamais été commercialisé aux États-Unis, grâce à une employée de la FDA qui avait retardé son approbation.
Cependant, Sherri commença à s’inquiéter. Quelques mois auparavant, son mari avait rapporté un somnifère d’Angleterre, qu’elle avait commencé à prendre pour soulager ses maux d’estomac. Mais elle se demanda ce qu’il contenait réellement.
Une Enquête Cruciale
Sherri consulta son médecin, qui lui conseilla de lui apporter le médicament pour analyse. Quelques jours plus tard, le médecin l’appela pour lui demander de revenir avec son mari. Ce moment marqua le début d’une série d’événements qui mettraient en lumière les dangers du thalidomide.
Un Combat pour la Sécurité
Je suis Katie Hafner et ceci est « Femmes Oubliées de la Science ». Dans les années 1950 et 1960, un médicament développé en Allemagne, présenté comme une panacée, a été commercialisé dans le monde entier : le thalidomide. Ce médicament a causé la naissance de milliers de bébés avec des membres raccourcis ou manquants, des malformations cardiaques, et beaucoup d’entre eux ont perdu la vie.
Aux États-Unis, cependant, le thalidomide n’a jamais été approuvé, grâce à une fonctionnaire de la FDA qui a joué un rôle clé dans ce refus : Frances Oldham Kelsey.
Un Nouveau Départ à la FDA
Le 1er août 1960, Frances Kelsey commence son travail à la FDA. Ce jour-là, la chaleur et l’humidité de Washington D.C. étaient typiques de l’été. Bien que le bâtiment temporaire où elle travaillait ne soit pas glamour, c’était un nouveau départ bienvenu pour elle.
Frances n’était pas seulement nouvelle à la FDA, mais aussi à D.C. Sa famille avait déménagé là cet été-là, après que son mari et elle aient trouvé des emplois dans la ville. Ils étaient ravis de quitter Vermillion, dans le Dakota du Sud, où ils ne se sentaient pas à leur place. Dans leur ancien quartier, la plupart des autres mères restaient à la maison avec leurs enfants, tandis que Frances était passionnée par la science.
Une Éducation Scientifique
Christine Kelsey, leur fille cadette, se souvient des discussions scientifiques entre ses parents pendant les repas. Bien que cela puisse sembler ennuyeux pour elle et sa sœur, ces conversations étaient le reflet de leur passion commune pour la recherche. Frances et Ellis s’étaient rencontrés en tant que collègues au département de pharmacologie de l’Université de Chicago en 1940 et avaient passé deux décennies à soutenir leurs carrières respectives.
Ils avaient une approche pragmatique de la vie familiale, planifiant les repas et engageant quelqu’un pour les tâches ménagères, afin de se concentrer sur leur travail. Christine se rappelle que chaque dîner était simple, composé d’une viande, de pommes de terre bouillies, d’une salade et d’un légume.
Un Héritage de Curiosité
En repensant à son éducation, Christine se souvient d’une leçon essentielle que ses parents lui ont transmise : remettre en question tout ce qui est présenté comme vérité. Cette approche critique serait cruciale pour Frances Kelsey dans sa carrière, alors qu’elle se préparait à faire face à des défis majeurs dans le domaine de la médecine.
L’Histoire de Frances Kelsey et son Impact sur la Sécurité Médicale
Une Carrière Débutante à la FDA
En août 1960, Frances Kelsey a rejoint la FDA en tant que l’une des rares évaluatrices médicales chargées d’examiner les essais cliniques associés aux demandes de nouveaux médicaments. Leur mission principale était de garantir que des preuves suffisantes démontraient la sécurité des médicaments pour les humains.
Un Métier Peu Envié
Peu de personnes aspiraient à ce poste. Les enfants ne rêvaient pas de devenir évaluateurs médicaux à la FDA. Bien que le diplôme en médecine soit la condition essentielle, de nombreux médecins préféraient la pratique privée, où les revenus étaient nettement plus élevés. À son arrivée, Frances a constaté que beaucoup de ses collègues étaient des jeunes diplômés qui travaillaient à temps partiel en attendant d’ouvrir leur propre cabinet.
Une Évaluatrice Expérimentée
Frances Kelsey se distinguait de ses pairs. À 46 ans, elle possédait non seulement un diplôme en médecine, mais aussi un doctorat en pharmacologie. De plus, elle avait une expérience significative en tant qu’évaluatrice pour le JAMA, le Journal de l’Association Médicale Américaine. Frances savait reconnaître la bonne science, tout comme la mauvaise.
Un Contexte Troublant
Cependant, quelques mois avant son arrivée, des auditions au Congrès avaient mis en lumière des pratiques douteuses dans l’industrie pharmaceutique. Barbara Moulton, une ancienne évaluatrice de la FDA, avait témoigné sur les relations trop amicales entre les évaluateurs et les entreprises pharmaceutiques, signalant que des médicaments inappropriés étaient approuvés.
Un Témoignage Courageux
Moulton avait dénoncé ces pratiques auprès de la Congrès Leonor Sullivan, qui plaidait pour la sécurité des consommateurs. Elle a ensuite été invitée à témoigner devant le sénateur Estes Kefauver, un fervent critique des entreprises pharmaceutiques. Son témoignage a révélé des problèmes majeurs dans le processus d’approbation des médicaments, qualifiant les responsables de la FDA d’incompétents.
Une Réaction Mitigée
Malgré la gravité de ses révélations, Moulton a été largement ignorée, souvent considérée comme une femme bruyante et dérangeante. Frances Kelsey, cependant, a pris note de ces événements. Elle a même avoué que le témoignage de Moulton l’avait fait douter de son choix de rejoindre la FDA. Néanmoins, elle a décidé de relever le défi et a commencé son travail le 1er août 1960, sans savoir que sa décision aurait des répercussions sur des milliers de familles.
Les Débuts de Frances à la FDA
Le premier mois de Kelsey à la FDA a été relativement calme, rempli de réunions et d’orientations. Cependant, après quelques semaines, ses supérieurs lui ont soumis deux nouvelles demandes de médicaments. L’une concernait un produit pour lavement qu’elle a approuvé rapidement, tandis que l’autre était pour un médicament nommé Kevadon.
L’Arrivée de Kevadon
Kevadon, un sédatif commercialisé par la société William S. Merrell, avait déjà connu un grand succès en Europe. Les consommateurs recherchaient un sédatif sûr, car les barbituriques, bien que populaires, étaient connus pour leur potentiel d’addiction et de surdose. Kevadon, contenant de la thalidomide, semblait être la solution idéale.
Une Confiance Mal Placée
La thalidomide, développée en Allemagne, avait généré d’importants bénéfices. Merrell espérait que son succès en Europe garantirait une approbation rapide aux États-Unis. Le 8 septembre 1960, la société a soumis sa demande à la FDA, convaincue que Frances Kelsey ne ferait que valider leur produit.
Une Époque d’Optimisme
Cheryl Warsh, historienne à l’Université de Vancouver Island, souligne que l’époque était marquée par un grand optimisme concernant les médicaments. Après la découverte de la pénicilline, de nombreux médicaments miracles avaient vu le jour, et l’idée que la chimie pouvait améliorer la vie était largement répandue.
Des Leçons du Passé
Cependant, l’histoire avait déjà montré des erreurs tragiques, comme celle de l’« élixir de sulfanilamide » en 1937, qui avait causé la mort de plus de 100 personnes, dont des enfants. Frances Kelsey, alors doctorante, avait été témoin de cette catastrophe, ce qui l’avait sensibilisée aux dangers potentiels des médicaments non testés.
Conclusion
Frances Kelsey, avec son expertise et sa détermination, allait jouer un rôle crucial dans la protection de la santé publique. Son parcours à la FDA ne faisait que commencer, mais son impact sur la sécurité des médicaments allait se révéler inestimable.
L’Importance de la Sécurité Médicale : L’Histoire de Frances Kelsey
Une Découverte Tragique
Frances Kelsey, une pharmacologue, a été impliquée dans une enquête cruciale pour comprendre les causes des décès liés à un médicament. Ce qui a été identifié comme étant la cause principale était le glycol diéthylique. En observant des rats de laboratoire exposés à cette substance, elle a constaté des symptômes alarmants, tels que des urines rouges, suivis de la mort des animaux. Cet incident a profondément marqué Kelsey, soulignant l’importance de la sécurité des médicaments.
Les Rôles de la FDA dans les Années 1930
Il est essentiel de préciser que la tragédie de 1937 ne relevait pas de la responsabilité de la FDA. À cette époque, la mission de l’agence se limitait à vérifier que les médicaments contenaient les ingrédients déclarés par les fabricants. Cependant, suite à la catastrophe de l’élixir de sulfanilamide, la FDA a été contrainte d’adopter une nouvelle approche : garantir la sécurité des médicaments avant leur mise sur le marché.
Le Processus de Soumission des Médicaments
Lorsque Frances Kelsey a rejoint la FDA, le processus de soumission d’un médicament était structuré. Les entreprises devaient présenter une demande de nouveau médicament (NDA) à la FDA. Cette demande se divisait en trois sections principales :
-
Section Chimie : Détaillant la composition du médicament et les méthodes de fabrication pour assurer une production constante et sans contaminants.
-
Section Pharmacologie : Présentant des études animales démontrant l’absence d’effets toxiques et la sécurité d’utilisation à long terme.
-
Essais Cliniques : Rapports de médecins ayant testé le médicament sur des patients, observant attentivement les réactions indésirables.
Frances était responsable de l’examen des essais cliniques.
L’Examen des Dossiers
Le processus d’examen était rigoureux. Les dossiers étaient répartis entre différentes équipes, chacune examinant une section spécifique. Si des réactions médicales anormales étaient détectées, les pharmacologues devaient vérifier si des effets similaires avaient été observés lors des tests sur animaux.
Frances et ses collègues ont rapidement réalisé que la demande de Kevadon, un médicament proposé par la société William S. Merrell, soulevait des questions. Bien que Merrell soit une entreprise respectée, le dossier de Kevadon contenait des incohérences, notamment des documents en allemand qui ne correspondaient pas parfaitement aux traductions fournies.
Des Incohérences Alarmantes
Dans la section pharmacologique, bien que les études animales semblaient prometteuses, un détail inquiétant a attiré l’attention de Frances. Le médicament, censé être non toxique, ne présentait aucune dose létale dans les tests sur animaux, même à des doses élevées. Cela soulevait des doutes : les animaux absorbaient-ils réellement le médicament ? Si ce n’était pas le cas, cela ne prouvait pas son innocuité pour les humains.
L’Essentiel des Essais Cliniques
Frances Kelsey a compris que les tests sur animaux ne suffisaient pas. Dans une interview, elle a souligné que pour évaluer un médicament, il était impératif de l’essayer sur des humains, car les réactions peuvent varier considérablement entre les espèces.
En examinant les données cliniques fournies par Merrell, elle a découvert que 1 589 patients avaient participé aux essais, mais les résultats étaient peu convaincants. Pour un examinateur moins expérimenté, ces données auraient pu sembler acceptables, mais Frances, avec son œil critique, a ressenti une frustration croissante face à la qualité des preuves présentées.
Conclusion : Un Héros de la Sécurité Médicale
Frances Kelsey a joué un rôle déterminant dans la protection du public contre les dangers potentiels des médicaments. Son approche méthodique et son scepticisme face aux données fournies ont permis d’éviter une catastrophe. Son histoire rappelle l’importance cruciale de la sécurité des médicaments et le besoin d’une vigilance constante dans le domaine de la santé.
La Controverse du Thalidomide : Un Regard Critique
Introduction à une Époque Troublée
Dans les années 1960, un médicament prometteur, le thalidomide, a suscité un grand intérêt, mais aussi de vives inquiétudes. Bien que des lettres et des résumés d’études aient été publiés, les rapports détaillés sur les patients ayant reçu ce traitement faisaient défaut. Les informations essentielles, telles que l’âge, le sexe, les conditions médicales traitées, les dosages administrés et les effets indésirables, étaient absentes. Ces données sont cruciales pour évaluer la sécurité d’un médicament.
Des Études Incomplètes
Un médecin a partagé ses résultats concernant 30 patients souffrant d’insomnie et 15 autres hospitalisés pour des troubles psychiatriques. Bien qu’il ait noté des effets secondaires tels que des éruptions cutanées, des vomissements et des convulsions, les détails sur les dosages et la durée du traitement manquaient. De plus, l’absence d’un groupe de contrôle placebo rendait difficile l’évaluation de l’efficacité du médicament. Les conclusions tirées de telles données sont donc peu fiables.
Les Doutes de Frances Kelsey
Frances Kelsey, une fonctionnaire de la FDA, a exprimé ses préoccupations lors d’une interview des années plus tard. Elle a souligné qu’il y avait quelque chose d’inquiétant dans les données, ou plutôt dans leur absence. Son scepticisme était fondé sur une analyse approfondie des documents fournis par Merrell, la société pharmaceutique derrière le thalidomide.
Une Pression Croissante
Merrell, convaincu du potentiel commercial du thalidomide, a exercé des pressions pour obtenir une approbation rapide, espérant le lancer sur le marché avant Noël. Ils avaient déjà imprimé des brochures et disposaient de matières premières pour produire 15 millions de pilules. Pendant ce temps, Frances Kelsey continuait de demander des informations supplémentaires, consciente que l’absence de données probantes ne lui permettait pas d’approuver le médicament.
Une Découverte Tragique
Alors que Frances Kelsey examinait minutieusement la demande d’approbation, une épidémie mystérieuse touchait des nourrissons en Europe. Les premiers cas étaient isolés, mais le nombre de bébés affectés augmentait rapidement, révélant des malformations congénitales graves. Ce phénomène inquiétant ne pouvait plus être ignoré.
L’Impact des Femmes dans cette Histoire
Cette affaire met en lumière le rôle crucial des femmes dans la protection de la santé publique. Des figures comme Barbara Moulton, qui a alerté sur les problèmes à la FDA, et Helen Taussig, qui a enquêté sur l’épidémie en Europe, ont été essentielles. Frances Kelsey, avec son expertise, a joué un rôle déterminant à une époque où la remise en question des prescriptions médicales était rare.
Conclusion : Un Avertissement Historique
L’histoire du thalidomide est complexe et s’est déroulée sur plusieurs années, avec des conséquences tragiques. La lenteur de la circulation de l’information a contribué à la catastrophe, exacerbée par le fait que des données cruciales étaient délibérément cachées. En 1960, alors qu’un médicament douteux était en attente d’approbation aux États-Unis, des milliers de personnes à travers le monde continuaient de l’utiliser, ignorant les dangers qui les guettaient.
Le thalidomide, connu sous divers noms à travers le monde, a laissé une empreinte indélébile sur l’histoire de la médecine et souligne l’importance d’une vigilance constante dans l’évaluation des médicaments.
La Lutte de Frances Kelsey contre le Thalidomide
Introduction
Frances Oldham Kelsey, une pharmacologue et médecin, est devenue une figure emblématique dans la lutte pour la sécurité des médicaments aux États-Unis. Son travail acharné a permis de prévenir la distribution d’un médicament dangereux, le thalidomide, qui a causé des malformations congénitales chez des milliers de bébés dans le monde.
Le Contexte Historique
Dans les années 1960, le thalidomide était présenté comme un remède miracle pour les nausées matinales chez les femmes enceintes. Cependant, Kelsey, alors employée par la Food and Drug Administration (FDA), a rapidement soulevé des doutes sur la sécurité de ce médicament. Elle a exigé des données supplémentaires avant d’accorder son approbation, ce qui a permis de sauver de nombreuses vies.
Les Conséquences du Thalidomide
Les effets dévastateurs du thalidomide ont été révélés lorsque des cas de malformations congénitales ont commencé à apparaître. Environ 10 000 enfants en Europe ont été touchés, tandis qu’aux États-Unis, grâce à l’intervention de Kelsey, le médicament n’a jamais été commercialisé. Ce scandale a conduit à des réformes majeures dans la réglementation des médicaments.
L’Héritage de Frances Kelsey
Frances Kelsey est souvent célébrée pour son intégrité et son engagement envers la santé publique. Son travail a non seulement empêché la catastrophe du thalidomide, mais a également conduit à des lois plus strictes concernant l’approbation des médicaments. En 1962, le Kefauver Harris Amendment a été adopté, renforçant les exigences de sécurité et d’efficacité pour les médicaments.
Lectures Complémentaires
Pour ceux qui souhaitent approfondir leurs connaissances sur ce sujet, plusieurs ouvrages sont disponibles :
- « Wonder Drug: The Secret History of Thalidomide in America and Its Hidden Victims » par Jennifer Vanderbes, publié en 2023, explore les conséquences du thalidomide aux États-Unis.
- « Frances Oldham Kelsey, the FDA, and the Battle against Thalidomide » par Cheryl Krasnick Warsh, à paraître en 2024, examine le rôle crucial de Kelsey dans cette affaire.
- Des articles académiques, tels que « Pathologic Effects of Elixir of Sulfanilamide (Diethylene Glycol) Poisoning: A Clinical and Experimental Correlation: Final Report », offrent des perspectives sur les effets des médicaments non testés.
Conclusion
L’héritage de Frances Kelsey perdure dans le domaine de la santé publique. Son courage et sa détermination à défendre la sécurité des patients continuent d’inspirer les professionnels de la santé et les régulateurs à travers le monde. Grâce à son travail, des vies ont été sauvées, et des réformes essentielles ont été mises en place pour protéger les générations futures.
Général
Une éruption mystérieuse qui a changé le climat et rendu le soleil bleu : découverte d’une île reculée du Pacifique
Une découverte fascinante a été faite par des chercheurs concernant une éruption volcanique survenue en 1831, qui a modifié le climat et rendu le soleil bleu. En étudiant les cendres dans les carottes de glace polaires, ils ont identifié le Zavaritskii, un volcan isolé des îles Kouriles, comme responsable de cet événement mystérieux. Cette éruption a entraîné un refroidissement climatique de 1 °C, provoquant des famines en Inde et au Japon. William Hutchison, volcanologue à l’Université de St Andrews, souligne que cette découverte révèle encore combien nous ignorons sur l’activité volcanique dans cette région reculée.

Découverte des Origines d’une Éruption Volcanique Historique
Des chercheurs ont récemment élucidé les origines d’une éruption volcanique survenue il y a 200 ans, qui a libéré une quantité massive de soufre dans l’atmosphère, entraînant un changement climatique notable et donnant au soleil une teinte bleue.
Un refroidissement Climatique en 1831
En 1831, la température moyenne dans l’hémisphère nord a chuté d’environ 1,8 degré Fahrenheit (soit environ 1 degré Celsius), coïncidant avec des rapports faisant état de conditions météorologiques sombres et de variations colourées du soleil. Bien que les scientifiques aient établi qu’une éruption volcanique majeure était à l’origine de ce phénomène étrange, le volcan responsable demeurait inconnu jusqu’à présent.
Pistes Découvertes dans les Cœurs Glaciaires
Afin d’identifier la source de cette éruption, les chercheurs ont analysé des cendres retrouvées dans des carottes glaciaires polaires. Leur étude a révélé que l’éruption provenait du volcan Zavaritskii situé sur l’île isolée de Simushir,qui fait partie des îles Kouriles contestées entre la Russie et le Japon. Pendant la guerre froide, l’Union soviétique avait utilisé un cratère volcanique inondé sur Simushir comme base secrète pour sous-marins nucléaires.
Les résultats publiés le 30 décembre 2024 dans la revue PNAS, soulignent combien il reste encore à découvrir concernant l’activité volcanique sur ces îles.
L’impact Météorologique Documenté
« Bien que 1831 soit une période relativement récente, nous n’avions aucune idée que ce volcan était à l’origine [de cette éruption dramatique] », a déclaré William Hutchison, auteur principal et volcanologue à l’Université St Andrews. « C’était complètement hors radar. »
L’éruption de 1831 fait partie d’une série d’éruptions volcaniques au XIXe siècle liées à la phase finale du Petit Âge Glaciaire, qui s’étendait approximativement entre 1800 et 1850. Ce phénomène n’était pas véritablement une période glaciaire — celle-ci ayant pris fin il y a environ dix mille ans — mais représentait néanmoins le moment le plus froid enregistré au cours des cinq derniers siècles.
Météo Dévastatrice en Europe
D’après Hutchison,il n’existe pas de témoignages écrits directs relatant cette éruption en raison du caractère éloigné et peu habité des îles Kouriles souvent enveloppées par un épais brouillard. Cependant, son impact est bien documenté : le compositeur allemand Felix Mendelssohn évoquait un été « désolé » en traversant les Alpes où les températures étaient « aussi froides qu’en hiver ». De nombreux récits rapportent également que le soleil prenait des teintes bleues ou violettes dues aux particules aérosols émises par le panache du volcan. Un phénomène similaire avait été observé après l’éruption du Krakatoa en 1883.

Dérives Mortelles Potentielles
L’éventuelle conséquence mortelle liée à cette éruption pourrait avoir été significative : une baisse globale des températures aurait précédé plusieurs famines majeures en Inde et au Japon durant les années 1830. Hutchison souligne : « Nous savons qu’avec de grandes éruptions volcaniques comme celle-ci, lorsque vous avez un refroidissement climatique cela entraîne aussi des modifications dans les précipitations ainsi que dans les rendements agricoles. » Cela peut engendrer une pénurie alimentaire pour la population.
Mise en Évidence Scientifique Cruciale
Afin d’identifier précisément la source de cet événement cataclysmique passé, Hutchison et son équipe ont examiné les résidus cendreux présents dans diverses carottes glaciaires datant du XIXe siècle prélevées au Groenland. La composition chimique correspondante aux cendres trouvées indiquait clairement leur origine commune avec celles provenant notamment du Japon voisin; cependant ils ont rapidement exclu ce pays comme site potentiel étant donné sa densité démographique élevée ainsi qu’un historique bien documenté concernant ses propres activités volcaniques.
Cela a conduit leurs recherches vers les îles Kouriles.
Sensation ‘Eureka’
L’équipe scientifique découvrit alors que la composition chimique présente aux dépôts cendreux issus du volcano Zavaritskii correspond parfaitement avec celle retrouvée dans ces carottes glaciaires; Hutchison qualifie cela comme étant un moment ‘Eureka’, semblable à celui où on trouve une empreinte digitale lors d’une enquête criminelle.
« C’était vraiment une journée fantastique, » se remémore-t-il avec enthousiasme; « l’une des meilleures journées passées au laboratoire. »
Alerte Manquante Sur Les Volcans Actuels
Tandis qu’ils avaient résolu ce mystère historique lié à l’éruption de 1831 , Hutchison note cependant qu’il n’existe toujours aucun système instrumentalisé surveillant activement toute activité potentielle autour des volcans situés aux îles Kouriles — situation valable pour bon nombre autres volcans autour globe.
« Si cette même éruption devait se produire aujourd’hui, » conclut-il prudemment ; « je ne pense pas que nous serions beaucoup mieux préparés comparativement à notre situation durant année 1831. » Cela illustre combien il sera difficile prédire quand ou où pourrait surgir prochainement un autre événement majeur susceptible modifier notre climat. »
Science et nature
La « reine des loups » de Yellowstone tuée par une meute rivale après 11 ans de vie et 10 portées de louveteaux
Le parc national de Yellowstone a perdu l’une de ses habitantes les plus emblématiques : Wolf 907F, surnommée la « Reine des Loups ». À 11 ans, cette louve au regard unique avait déjà donné naissance à un incroyable nombre de 10 portées. Sa longévité exceptionnelle et son rôle de matriarche en faisaient une figure légendaire. Malheureusement, après une confrontation avec un groupe rival le jour de Noël, sa vie s’est éteinte. Malgré les défis qu’elle a affrontés, Wolf 907F a su mener sa meute avec force et détermination jusqu’à la fin.

Le parc national de Yellowstone a perdu l’un de ses habitants les plus emblématiques et résilients : une louve d’un œil, âgée de 11 ans, qui avait réalisé un exploit en donnant naissance à 10 portées au cours de sa longue vie.
Connue sous le nom affectueux de « Reine des Loups » pour son rôle prépondérant au sein du groupe Junction Butte, la louve 907F est décédée le jour de Noël (25 décembre 2024) suite à une confrontation avec un autre groupe rival.
La louve 907F a vécu plus du double de l’espérance de vie habituelle des loups gris dans le parc, qui est généralement comprise entre quatre et cinq ans. Sa longévité et son statut de matriarche en ont fait une figure légendaire dans l’écosystème du parc ainsi qu’auprès des passionnés d’animaux sauvages.
les événements ayant conduit à sa mort ont débuté le 22 décembre, lorsque la louve 907F et ses petits se nourrissaient d’une carcasse de bison sur la rive nord du fleuve Yellowstone, d’après Cowboy State Daily.Des membres du groupe rival Rescue Creek — habituellement confinés sur la rive sud — ont traversé le fleuve sans prévenir et se sont engagés dans une violente altercation avec le groupe dirigé par 907F.
Bien que la louve ait survécu à cette première rencontre, ses blessures se sont révélées fatales. Son collier radio, surveillé par les biologistes du parc Yellowstone, a signalé son immobilité le 26 décembre, indiquant qu’elle était probablement décédée la veille.
Une des plus anciennes louves de Yellowstone

Avec ses onze années passées dans ce milieu sauvage depuis leur réintroduction en 1995 au parc national yellowstone,d’après Smithsonian Magazine, elle faisait partie des six rares spécimens ayant atteint cet âge avancé.
Louve courageuse face aux défis rencontrés tout au long de sa vie. Les scientifiques pensent qu’elle aurait perdu son œil gauche vers l’âge four; cependant, les raisons exactes demeurent floues. de plus, elle avait survécu à un épisode sévère dû à la gale — maladie cutanée contagieuse causée par des acariens microscopiques pouvant être mortels.

Même face aux adversités rencontrées tout au long des années passées en tant que leader efficace pour son groupe familial , elle a réussi à donner naissance encore une fois lors du printemps dernier (2024), surprenant ainsi les chercheurs par sa vitalité malgré son âge avancé.
Ayant mis bas chaque année durant toute une décennie avant sa mort dès qu’elle atteignit maturité sexuelle , Rabe affirmait auprès du Cowboy State Daily que cela faisait d’elle « la femelle ayant connu le succès reproductif sans précédent dans toute l’histoire connue ».
Science et nature
Les meilleures offres du MacBook Pro ce mois-ci !
Apple a récemment dévoilé ses nouveaux modèles de MacBook Pro de 14 et 16 pouces, équipés des puissants processeurs M4, M4 Pro et M4 Max. Ces modèles améliorés, lancés en novembre 2024, offrent le double de RAM par rapport à leurs prédécesseurs. Si vous envisagez d’acheter un MacBook Pro, sachez que les anciens modèles M3 sont désormais en liquidation avec des remises intéressantes. Cependant, attention à la différence de RAM ! Découvrez nos conseils pour dénicher les meilleures offres et faire le choix parfait pour vos besoins.

Les Nouveaux Modèles de MacBook Pro : Ce Qu’il Faut Savoir
En octobre 2024, Apple a dévoilé ses derniers modèles de MacBook Pro de 14 et 16 pouces, équipés des puces M4, M4 Pro et M4 Max. Ces nouvelles versions arrivent un an après le lancement des variantes M3, qui avaient déjà fait sensation. Les nouveaux modèles offrent une double capacité de RAM par rapport à leurs prédécesseurs.
Les ventes ont débuté le vendredi 8 novembre et les appareils sont désormais disponibles à l’achat.
Acheter un MacBook Pro : Faut-il opter pour les anciens modèles ?
Si vous envisagez d’acheter un MacBook Pro, vous pourriez être tenté par les modèles de la série M3 qui pourraient bénéficier de réductions alors que les revendeurs écoulent leur stock.Cependant, gardez à l’esprit que ces anciens modèles disposent d’une moitié moins de RAM que les nouveaux. Apple facture environ 200 $/200 £ pour une mise à niveau de la RAM au moment de l’achat ; il est donc essentiel que toute réduction sur un ancien modèle prenne cela en compte. De plus, si vous êtes en dehors des États-Unis, notez que le prix des nouveaux modèles peut être inférieur à celui des anciens.
avec une combinaison d’augmentations et diminutions tarifaires dans toute la gamme par rapport aux générations précédentes, il peut s’avérer difficile d’identifier une bonne affaire. Heureusement, notre équipe d’experts apple scrute Internet tout au long de l’année pour dénicher les meilleures offres sur le MacBook pro ainsi que sur le MacBook Air qui présente également plusieurs similitudes avec son homologue pro.
Comparaison des Prix Actuels
Vous trouverez ci-dessous des tableaux comparatifs affichant les meilleurs prix actuels pour chaque modèle standard du MacBook Pro (y compris ceux mis en vente depuis le 8 novembre). Des offres sont également disponibles pour certains modèles désormais discontinués tant qu’ils restent en stock chez divers détaillants.
Aperçu des Meilleures Offres Actuelles
- M4 – MacBook Pro 14 pouces :
- Amazone : modèle avec 512 Go/16 Go RAM – $1,459 (140 $ off)
- Amazone : Modèle avec 1 To/24 Go RAM – $1,819 (180 $ off)
- Amazone : Modèle M4 Pro avec 1 To/24 Go RAM – $2,179 (220 $ off)
- Amazone : Modèle M4 Max avec 16 pouces – À partir de $3,174 (325 $ off)
Détails Sur Les Offres Discontinuées
- M3 – ancien modèle :
- B&H photo: Modèle avec 512 Go/18 Go RAM – Environ $1,599 (-400$)
- Best Buy: Version précédente du modèle pro – Environ $2,199 (-300$)
L’Importance D’un Guide D’Achat Complet
Pour obtenir davantage d’informations et choisir votre ordinateur portable Apple idéalement adapté à vos besoins spécifiques ou professionnels , consultez notre guide complet où nous abordons tous les différents types disponibles ainsi qu’un guide spécifique aux achats concernant toute la gamme Macintosh.
Démarche Pour Acquérir Un Nouveau Produit Apple
Tandis qu’il est possible d’acquérir directement auprès d’Apple ou via divers revendeurs agréés dans le monde entier — beaucoup offrant aussi bien sur produits neufs qu’anciens — il vaut toujours mieux comparer avant achat afin maximiser vos économies potentielles ! Vous pouvez consulter nos recommandations concernant où acheter votre prochain appareil Macintosh ici même !
Détaillants Recommandés Aux États-Unis :
- Boutique officielle Apple
- Boutique Éducation Apple
- Amazone
< li>B&H Photo < li > Best Buy < / li >< li > Walmart < / li >< / ul >
< h r >
< h r >
< p > Si vous recherchez encore plus moyen économe , découvrez si acheter vos produits électroniques depuis un autre pays pourrait réduire considérablement votre budget .< / p >
< h r >
< h r >
< h o u t e s t i n g = "u k retailers" >Détaillants Recommandés Au Royaume-Uni:
< ul >< li > Boutique officielle Apple< / li >< li > Boutique Éducation Apple< / li >< li > Amazone< / li >< < ...
-

 Business1 an ago
Business1 an agoComment lutter efficacement contre le financement du terrorisme au Nigeria : le point de vue du directeur de la NFIU
-
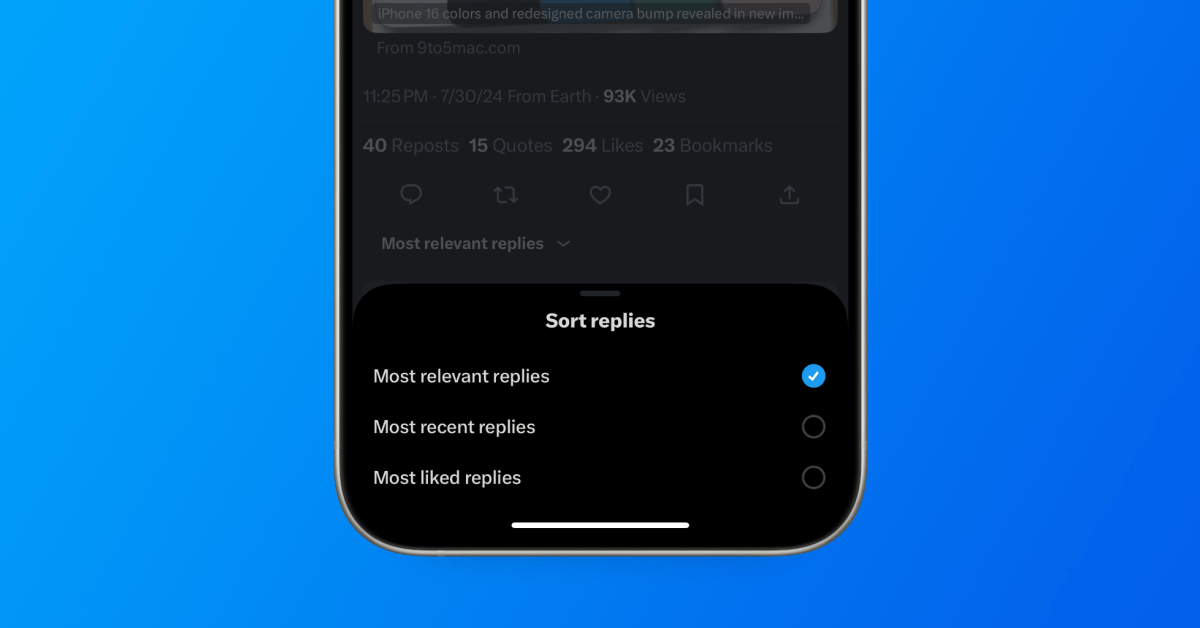
 Général2 ans ago
Général2 ans agoX (anciennement Twitter) permet enfin de trier les réponses sur iPhone !
-

 Technologie1 an ago
Technologie1 an agoTikTok revient en force aux États-Unis, mais pas sur l’App Store !
-

 Général1 an ago
Général1 an agoAnker SOLIX dévoile la Solarbank 2 AC : la nouvelle ère du stockage d’énergie ultra-compatible !
-

 Général1 an ago
Général1 an agoLa Gazelle de Val (405) : La Star Incontournable du Quinté d’Aujourd’hui !
-

 Sport1 an ago
Sport1 an agoSaisissez les opportunités en or ce lundi 20 janvier 2025 !
-

 Business1 an ago
Business1 an agoUne formidable nouvelle pour les conducteurs de voitures électriques !
-

 Science et nature1 an ago
Science et nature1 an agoLes meilleures offres du MacBook Pro ce mois-ci !









