Général
La FDA approuve la première thérapie cellulaire innovante pour lutter contre les tumeurs solides !
Une avancée majeure dans le traitement du sarcome synovial ! L’approbation accélérée de afamitresgene autoleucel (Tecelra) par la FDA marque une étape historique en tant que première thérapie cellulaire ingénierie pour une tumeur solide. Destinée aux adultes atteints de sarcome synovial avancé, cette immunothérapie utilise les propres cellules immunitaires du patient pour cibler les cellules cancéreuses. Avec un taux de réponse global de 43,2%, cette innovation offre un nouvel espoir à ceux qui n’ont plus d’options de traitement. Une lueur d’espoir pour les patients et leurs familles !
Médecine — Approvisionnement d’Afamitresgene autoleucel (Tecelra) pour le sarcome synovial métastatique
La FDA a accordé une approbation accélérée à l’afamitresgene autoleucel (afami-cel, Tecelra) pour le traitement du sarcome synovial avancé, marquant ainsi la première thérapie cellulaire ingénierie approuvée pour une tumeur solide.
Ce traitement par immunothérapie à base de cellules T autologues est spécifiquement destiné aux adultes atteints de maladies non résécables ou métastatiques ayant déjà reçu une chimiothérapie. Pour être éligibles, les patients doivent être positifs pour les antigènes HLA-A*02:01P, -A*02:02P, -A*02:03P ou -A*02:06P et avoir une tumeur exprimant l’antigène MAGE-A4, comme déterminé par un diagnostic compagnon.
Avec cette approbation, la thérapie génique par récepteur des cellules T devient la première nouvelle option thérapeutique en plus de dix ans pour le sarcome synovial, un cancer rare des tissus mous qui se développe le plus souvent dans les membres.
« Les cancers potentiellement mortels comme le sarcome synovial continuent d’avoir un impact dévastateur sur les individus, en particulier ceux pour qui les traitements standards ont une efficacité limitée en raison de la croissance et de la progression tumorale », a déclaré Peter Marks, MD, PhD, directeur du Centre d’évaluation et de recherche des biologiques de la FDA.
L’approbation a été fondée sur les résultats du premier groupe de l’essai SPEARHEAD-1, qui a inclus 44 patients atteints de sarcome synovial avancé. Un traitement unique avec afami-cel a entraîné un taux de réponse global de 43,2 % et un taux de réponse complète de 4,5 %. La durée médiane de la réponse était de 6 mois, et 39 % des répondants ont présenté une réponse d’une durée d’un an ou plus.
« Tecelra, qui utilise les propres cellules immunitaires de chaque patient pour reconnaître et attaquer les cellules cancéreuses lors d’un traitement par perfusion unique, se distingue considérablement des normes de soins actuelles pour le sarcome synovial avancé », a déclaré Sandra D’Angelo, MD, investigatrice au Memorial Sloan Kettering Cancer Center à New York, dans un communiqué de presse d’Adaptimmune.
Environ 1 000 cas de sarcome synovial sont diagnostiqués chaque année aux États-Unis, touchant principalement des hommes adultes dans la trentaine ou plus jeunes. La plupart des patients recevant des traitements standards pour une maladie avancée connaissent des récidives et passent par de nombreuses lignes de thérapie, épuisant souvent toutes les options disponibles. Le taux de survie à 5 ans pour les patients atteints de maladie métastatique est d’environ 20 %.
« Cette approbation représente une nouvelle option très attendue pour les personnes diagnostiquées avec ce sarcome et constitue une étape importante pour l’utilisation des thérapies cellulaires dans les cancers des tumeurs solides », a ajouté D’Angelo.
À l’instar des thérapies CAR T-cellules, l’étiquetage d’afami-cel comporte un avertissement encadré concernant le syndrome de libération de cytokines (CRS). Dans les essais, le CRS a été observé chez 75 % des patients (2 % de grade ≥3), avec un début médian de 2 jours et une résolution médiane de 3 jours ; les symptômes courants du CRS comprenaient de la fièvre, une tachycardie, une hypotension, des nausées/vomissements et des maux de tête. Cet effet secondaire a été géré avec du tocilizumab (Actemra) chez 55 % des patients ayant présenté un CRS.
En plus du CRS, les événements indésirables courants (incidence ≥20 %) associés à afami-cel comprenaient des nausées, des vomissements, de la fatigue, des infections, de la fièvre, de la constipation, des difficultés respiratoires, des douleurs abdominales, des douleurs thoraciques non cardiaques, une diminution de l’appétit, une tachycardie, des douleurs dorsales, une hypotension, de la diarrhée et un œdème, ainsi que des taux réduits de globules blancs, de globules rouges et de plaquettes.
Un syndrome de neurotoxicité associé aux cellules effectrices immunitaires a été observé chez un patient après l’administration d’afami-cel (début au bout de 2 jours, résolution après 1 jour) et est inclus parmi les avertissements et précautions dans les informations de prescription. D’autres avertissements incluent des risques de cytopénie sévère, de cancers secondaires, d’infections et d’effets sur la conduite ou l’utilisation de machines.
Général
Anker SOLIX dévoile la Solarbank 2 AC : la nouvelle ère du stockage d’énergie ultra-compatible !
Découvrez le Solarbank 2 AC, une véritable révolution dans le domaine de l’énergie solaire ! Grâce à ses batteries au phosphate de fer lithium, ce système s’adapte parfaitement à vos besoins. Avec une puissance impressionnante de 2400 watts et la possibilité d’ajouter jusqu’à cinq batteries supplémentaires, il assure un stockage optimal. Sa compatibilité avec le compteur Anker SOLIX Smart favorise une gestion intelligente de votre consommation énergétique. Ne ratez pas l’offre spéciale « early bird », disponible dès maintenant pour seulement 999 euros ! Saisissez cette chance unique !

Le Solarbank 2 AC : Une Révolution dans le Stockage Énergétique
Batteries au Lithium Fer Phosphate
Le Solarbank 2 AC se démarque par l’utilisation de batteries au lithium fer phosphate (LFP), reconnues pour leur sécurité et leur efficacité. Ce modèle est particulièrement innovant grâce à son système de couplage alternatif, qui lui permet de s’adapter facilement à divers systèmes solaires déjà en place.Que ce soit pour des installations sur toiture, des systèmes solaires compacts pour balcons ou d’autres configurations réduites, il peut fonctionner avec un micro-onduleur de 800 Watts.
Capacité et flexibilité Énergétique
Avec une capacité maximale d’injection dans le réseau domestique atteignant 1200 watts,le Solarbank 2 AC peut être associé à deux régulateurs solaires MPPT. Cela ouvre la possibilité d’ajouter jusqu’à 1200 watts supplémentaires via des panneaux solaires additionnels, portant ainsi la puissance totale à un impressionnant 2400 watts. Pour les utilisateurs nécessitant davantage de stockage énergétique, il est possible d’intégrer jusqu’à cinq batteries supplémentaires de 1,6 kilowattheure chacune, augmentant la capacité totale à 9,6 kilowattheures.
Intégration dans un Écosystème Intelligent
Le Solarbank 2 AC s’intègre parfaitement dans un écosystème énergétique intelligent grâce à sa compatibilité avec le compteur Anker SOLIX Smart et les prises intelligentes proposées par Anker. cette fonctionnalité permet une gestion optimisée de la consommation électrique tout en réduisant les pertes énergétiques inutiles. De plus, Anker SOLIX prévoit d’étendre cette compatibilité aux dispositifs Shelly.
Durabilité et Résistance aux Intempéries
Anker SOLIX met également l’accent sur la longévité du Solarbank 2 AC. Conçu pour supporter au moins 6000 cycles de charge, cet appareil a une durée de vie estimée dépassant quinze ans. Il est accompagné d’une garantie fabricant décennale et possède une certification IP65 qui assure sa résistance face aux intempéries tout en étant capable de fonctionner dans des températures variant entre -20 °C et +55 °C.
Disponibilité et Offres Promotionnelles
Le solarbank 2 AC est disponible sur le site officiel d’Anker SOLIX ainsi que sur Amazon au prix standard de 1299 euros. Cependant, une offre promotionnelle « early bird » sera active du 20 janvier au 23 février 2025, permettant aux acheteurs intéressés d’acquérir cet appareil dès 999 euros ! Cette promotion inclut également un compteur Anker SOLIX Smart offert pour chaque commande passée durant cette période spéciale.
le Solarbank 2 AC représente une avancée significative dans le domaine du stockage énergétique domestique grâce à ses caractéristiques techniques avancées et son engagement envers la durabilité environnementale.
Business
Une formidable nouvelle pour les conducteurs de voitures électriques !
Excellente nouvelle pour les conducteurs de véhicules électriques ! La recharge gratuite sur le lieu de travail sera exonérée d’impôts jusqu’en 2025. Annoncée par le ministère de l’Économie, cette mesure incitative, en place depuis 2020, s’inscrit dans une dynamique de croissance impressionnante avec une progression annuelle moyenne de 35%. Les entreprises peuvent ainsi offrir des bornes de recharge sans impact fiscal, stimulant la transition écologique. Reste à savoir si cela suffira à convaincre les entreprises hésitantes et à propulser l’électrification des flottes professionnelles vers un avenir durable.

Technologie
Recharge Électrique au Bureau : Une Exonération Fiscale Renouvelée
Les détenteurs de véhicules électriques et leurs employeurs peuvent se réjouir : la possibilité d’effectuer des recharges gratuites sur le lieu de travail sera exonérée d’impôts jusqu’en 2025. Cette décision, annoncée par le ministère des Finances, prolonge une initiative lancée en 2020 pour encourager l’adoption des véhicules électriques dans les entreprises.
Un Secteur en Croissance Dynamique
Cette prolongation intervient à un moment clé, alors que le marché des voitures électriques continue d’afficher une croissance remarquable. Entre 2020 et 2022, la progression annuelle moyenne a atteint 35%. En 2023, les particuliers représentent désormais 84% des acquisitions de véhicules électriques, contre seulement 68% en 2018.
Concrètement,cette mesure permet aux sociétés d’installer gratuitement des bornes de recharge pour leurs employés sans impact fiscal. Les frais liés à l’électricité pour ces recharges ne seront pas pris en compte dans le calcul des avantages en nature. De plus, un abattement de 50% sur ces avantages est maintenu avec un plafond révisé à environ 2000 euros pour l’année prochaine.
Accélération Vers une Mobilité Électrique
Cette initiative fait partie d’une stratégie globale visant à promouvoir l’électrification du parc automobile français. Cependant, les grandes entreprises rencontrent encore des difficultés pour atteindre leurs objectifs ; seulement 8% des nouveaux véhicules immatriculés par ces entités étaient électriques en 2023. Ces incitations fiscales pourraient néanmoins inciter davantage d’employeurs à franchir le pas.Cependant, plusieurs défis demeurent concernant les infrastructures nécessaires au chargement ainsi que sur l’autonomie des véhicules et les perceptions parmi les employés. Par ailleurs, la réduction progressive du bonus écologique pour les utilitaires et sa diminution pour les particuliers pourraient freiner cet élan vers une adoption plus large.
Avenir Prometteur Pour La Mobilité Électrique
Malgré ces obstacles potentiels, il existe un optimisme quant au futur de la mobilité électrique dans le milieu professionnel. Les avancées technologiques continues ainsi qu’un engagement croissant envers la durabilité devraient continuer à favoriser cette tendance vers une adoption accrue des véhicules écologiques.
En maintenant ces mesures fiscales avantageuses jusqu’en 2025 et au-delà, le gouvernement délivre un message fort soutenant la transition écologique dans le secteur du transport. Reste maintenant à voir si cela suffira réellement à convaincre certaines entreprises hésitantes et si cela permettra d’accélérer significativement l’électrification de leurs flottes professionnelles dans un avenir proche.
Divertissement
« À la rencontre d’un Hugo : une aventure inattendue »
Le prénom, un véritable reflet de notre identité, peut être à la fois lourd à porter et source de fierté. Dans cette chronique fascinante, le réalisateur Hugo David nous plonge dans son expérience avec un prénom très répandu. Né en 2000, il se retrouve entouré d’autres Hugo, ce qui l’amène à adopter un alias : Hugo D.. Comment ce choix a-t-il influencé son parcours ? Explorez les nuances et les histoires derrière nos prénoms et découvrez comment ils façonnent nos vies dès l’enfance jusqu’à l’âge adulte !

Les Prénoms : Un Voyage au Cœur de l’Identité
Le Rôle Crucial des Prénoms dans nos Existences
Chaque personne possède un prénom, qu’il soit courant ou singulier, et ce dernier peut engendrer à la fois fierté et embarras. Cet article explore la signification profonde et l’influence des prénoms sur notre vie quotidienne. Le réalisateur Hugo David partage son vécu avec un prénom qui a connu une forte popularité durant sa jeunesse.
une Naissance Sous le Signe de la Célébrité
Hugo David est né en 2000 à Tours, une époque où le prénom Hugo était en plein essor. Ses parents, Caroline et Rodolphe, avaient envisagé d’autres choix comme Enzo, également très en vogue à cette période. « Je pense que mes parents ont opté pour un prénom parmi les plus répandus en France plutôt qu’en hommage à Victor Hugo », confie-t-il.
Une Enfance Entourée d’Autres « Hugo »
Dès son plus jeune âge, Hugo se retrouve entouré d’autres enfants portant le même nom. Selon les statistiques de l’Insee,7 694 garçons ont été prénommés Hugo en 2000,faisant de ce prénom le quatrième plus populaire cette année-là. À l’école primaire,il côtoie plusieurs camarades appelés Thibault et autres prénoms similaires. Pour éviter toute confusion lors des appels en classe, les enseignants ajoutent souvent la première lettre du nom de famille après le prénom : ainsi devient-il rapidement « Hugo D. », un surnom auquel il s’habitue sans arduousé.
Pensées sur l’Identité Associée au Prénom
Le choix d’un prénom peut avoir un impact significatif sur notre identité personnelle tout au long de notre existence. Que ce soit pour se distinguer ou pour s’intégrer dans un groupe social spécifique, chaque individu développe une relation particulière avec son propre nom.
les prénoms ne sont pas simplement des désignations ; ils portent avec eux des récits et influencent nos interactions sociales depuis notre enfance jusqu’à l’âge adulte.
-

 Business1 an ago
Business1 an agoComment lutter efficacement contre le financement du terrorisme au Nigeria : le point de vue du directeur de la NFIU
-
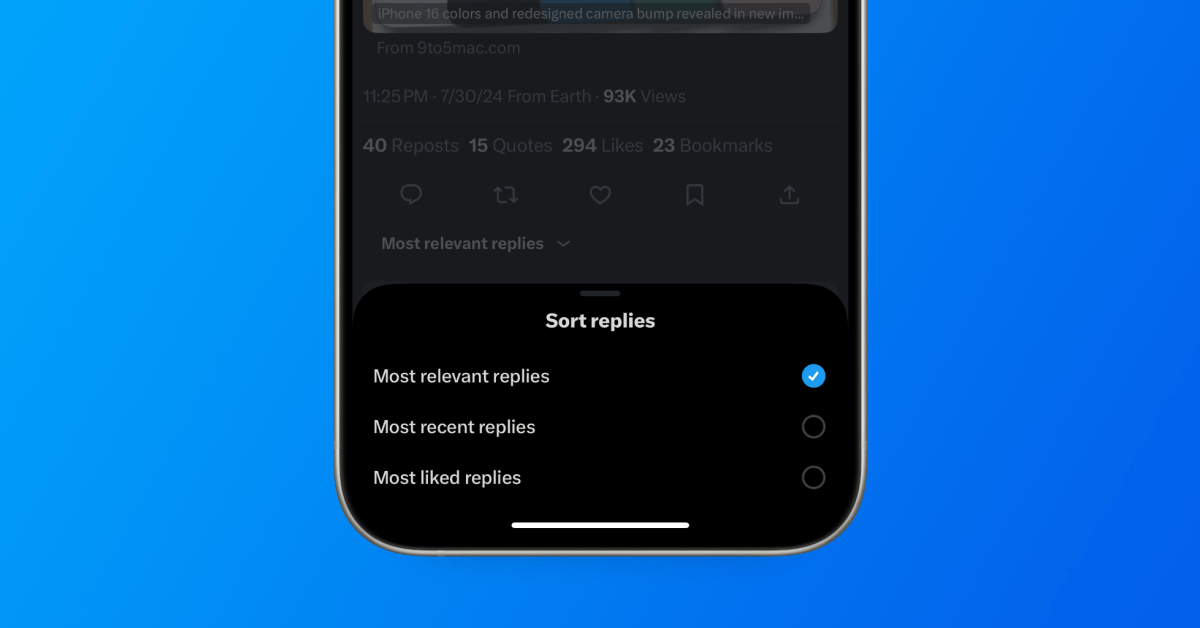
 Général2 ans ago
Général2 ans agoX (anciennement Twitter) permet enfin de trier les réponses sur iPhone !
-

 Technologie1 an ago
Technologie1 an agoTikTok revient en force aux États-Unis, mais pas sur l’App Store !
-

 Général1 an ago
Général1 an agoAnker SOLIX dévoile la Solarbank 2 AC : la nouvelle ère du stockage d’énergie ultra-compatible !
-

 Général1 an ago
Général1 an agoLa Gazelle de Val (405) : La Star Incontournable du Quinté d’Aujourd’hui !
-

 Sport1 an ago
Sport1 an agoSaisissez les opportunités en or ce lundi 20 janvier 2025 !
-

 Business1 an ago
Business1 an agoUne formidable nouvelle pour les conducteurs de voitures électriques !
-

 Science et nature1 an ago
Science et nature1 an agoLes meilleures offres du MacBook Pro ce mois-ci !











