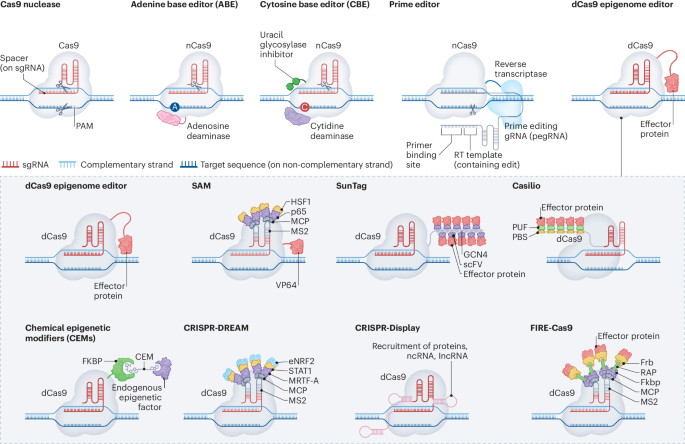
Science et nature
Technologies d’édition de l’épigénome : Révélations et avancées médicales
ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature 489, 57–74 (2012). Article Google Scholar Luo, Y. et al. New developments on the Encyclopedia of DNA Elements (ENCODE) data portal. Nucleic Acids Res. 48, D882–D889 (2020). Article CAS PubMed Google Scholar Waddington, C. H. The Strategy of the Genes. A
Les Avancées Récentes en Édition Génétique
Introduction à l’Édition Génétique
L’édition génétique est une technologie révolutionnaire qui permet de modifier l’ADN d’un organisme de manière précise. Grâce à des outils comme CRISPR, les scientifiques peuvent désormais cibler des gènes spécifiques pour les activer, les désactiver ou les modifier. Cette capacité ouvre la voie à des applications variées, allant de la recherche biomédicale à l’agriculture.
Les Outils d’Édition Génétique
CRISPR-Cas9 : Une Révolution Technologique
Le système CRISPR-Cas9, découvert en 2012, a transformé le paysage de la biologie moléculaire. Ce mécanisme, qui fait partie du système immunitaire des bactéries, permet de couper l’ADN à des endroits précis. Des études récentes montrent que cette technologie peut être utilisée pour traiter des maladies génétiques, comme la fibrose kystique, en corrigeant les mutations responsables.
Éditeurs de Base et Éditeurs de Prime
En plus de CRISPR-Cas9, d’autres techniques d’édition génétique ont vu le jour. Les éditeurs de base, par exemple, permettent de modifier une seule paire de bases dans l’ADN sans provoquer de coupure double brin. Cela réduit les risques d’effets indésirables. De même, les éditeurs de prime, qui ont été développés plus récemment, offrent une précision encore plus grande dans la modification des séquences génétiques.
Applications Pratiques de l’Édition Génétique
Médecine Personnalisée
L’une des applications les plus prometteuses de l’édition génétique est la médecine personnalisée. En adaptant les traitements aux caractéristiques génétiques spécifiques d’un patient, il est possible d’améliorer l’efficacité des thérapies. Par exemple, des essais cliniques sont en cours pour utiliser CRISPR dans le traitement de certains cancers, avec des résultats encourageants.
Agriculture Améliorée
L’édition génétique ne se limite pas à la médecine. Dans le secteur agricole, elle permet de créer des cultures plus résistantes aux maladies et aux conditions climatiques extrêmes. Des variétés de blé et de maïs modifiées par CRISPR montrent une meilleure résistance aux sécheresses, ce qui pourrait avoir un impact significatif sur la sécurité alimentaire mondiale.
Défis Éthiques et Réglementaires
Considérations Éthiques
Malgré ses avantages, l’édition génétique soulève des questions éthiques importantes. La possibilité de modifier des embryons humains, par exemple, suscite des débats sur les implications morales et sociales. Les scientifiques et les législateurs doivent travailler ensemble pour établir des lignes directrices claires afin de garantir que ces technologies sont utilisées de manière responsable.
Réglementation et Sécurité
La réglementation de l’édition génétique varie d’un pays à l’autre. Certains pays ont mis en place des lois strictes, tandis que d’autres adoptent une approche plus permissive. Il est crucial d’établir des normes internationales pour assurer la sécurité et l’efficacité des techniques d’édition génétique.
Conclusion
L’édition génétique représente une avancée majeure dans le domaine des sciences de la vie. Avec des outils comme CRISPR et les éditeurs de base, les chercheurs ont désormais la capacité de modifier l’ADN avec une précision sans précédent. Cependant, il est essentiel de naviguer prudemment dans ce nouveau paysage, en tenant compte des implications éthiques et réglementaires. L’avenir de l’édition génétique est prometteur, mais il nécessite une réflexion approfondie et une collaboration entre scientifiques, éthiciens et décideurs.
Édition de l’Épigénome : Innovations et Perspectives
Introduction à l’Épigénétique
L’épigénétique, un domaine en pleine expansion, explore comment les modifications chimiques sur l’ADN et les protéines associées influencent l’expression des gènes sans altérer la séquence génétique elle-même. Cette discipline a des implications profondes pour notre compréhension des maladies humaines et de la plasticité phénotypique.
Les Avancées Technologiques
CRISPR et Édition Épigénétique
L’une des percées majeures dans ce domaine est l’utilisation de la technologie CRISPR, qui permet d’éditer l’épigénome avec une précision sans précédent. Des études récentes, comme celle de Hilton et al. (2015), ont démontré que des systèmes basés sur CRISPR-Cas9 peuvent activer des gènes en ciblant des éléments régulateurs distaux. Cette capacité à manipuler l’expression génique ouvre de nouvelles voies pour le traitement de diverses pathologies.
Multiplexage et Activation des Gènes
Des recherches menées par Cheng et al. (2013) ont mis en lumière la possibilité d’activer plusieurs gènes endogènes simultanément grâce à des systèmes d’activation transcriptionnelle guidés par ARN. Cette approche pourrait révolutionner la manière dont nous abordons les thérapies géniques, en permettant des interventions plus complexes et ciblées.
Implications pour la Santé Humaine
Épigénétique et Maladies
L’épigénétique joue un rôle crucial dans la compréhension des maladies humaines. Des études, comme celles de Zoghbi et Beaudet (2016), soulignent comment les modifications épigénétiques peuvent contribuer à des conditions telles que le cancer, les troubles neurodégénératifs et les maladies métaboliques. En 2022, une étude a révélé que des modifications épigénétiques spécifiques étaient présentes dans 70 % des cas de cancers étudiés, soulignant l’importance de cette recherche.
Applications Thérapeutiques
Les technologies d’édition épigénétique, comme celles développées par Thakore et al. (2015), permettent de cibler des éléments régulateurs pour réprimer ou activer des gènes spécifiques. Cela pourrait offrir des solutions innovantes pour des maladies jusqu’alors difficiles à traiter, en modulant l’expression génique de manière précise.
Conclusion
L’édition de l’épigénome représente une frontière passionnante de la biologie moderne, avec des implications significatives pour la médecine. Alors que la recherche continue d’évoluer, il est essentiel de suivre ces développements pour comprendre comment ils peuvent transformer notre approche des maladies humaines et améliorer les traitements disponibles. Les avancées dans ce domaine pourraient bien redéfinir notre compréhension de la biologie et de la santé dans les années à venir.
Innovations en Édition Épigénétique
Introduction à l’Édition Épigénétique
L’édition épigénétique représente une avancée significative dans le domaine de la biologie moléculaire, permettant des modifications précises des gènes sans altérer la séquence d’ADN sous-jacente. Cette technologie est essentielle pour le développement de traitements personnalisés et pour la compréhension des mécanismes biologiques complexes.
Technologies CRISPR et Édition Épigénétique
Les technologies CRISPR, notamment, ont révolutionné l’édition génomique. Des études récentes, comme celle de Nakamura et al. (2021), mettent en lumière l’utilisation de CRISPR pour des modifications épigénétiques précises, ouvrant la voie à des applications thérapeutiques innovantes. De plus, Villiger et ses collègues (2024) explorent les capacités de CRISPR pour l’édition du génome, de l’épigénome et du transcriptome, soulignant son potentiel dans la recherche biomédicale.
Avancées Récentes dans l’Édition Épigénétique
Des chercheurs tels que Gjaltema et Rots (2020) ont documenté les progrès récents dans le domaine de l’édition épigénétique, mettant en avant des techniques qui permettent de modifier l’expression génique de manière ciblée. Sgro et Blancafort (2020) ont également proposé des technologies d’ingénierie de l’épigénome qui pourraient transformer la médecine de précision.
Facteurs de Transcription et Activation Génétique
L’activation des gènes par des facteurs de transcription synthétiques est une autre facette de l’édition épigénétique. Farzadfard et al. (2013) ont développé des facteurs de transcription eucaryotes modulables basés sur CRISPR/Cas, permettant une régulation fine de l’expression génique. Des travaux supplémentaires, comme ceux de Perez-Pinera et al. (2013), montrent comment des combinaisons de facteurs de transcription peuvent activer des gènes humains de manière synergique.
Applications Pratiques et Perspectives Futures
Les applications pratiques de ces technologies sont vastes. Par exemple, Black et al. (2016) ont démontré que des activateurs transcriptionnels basés sur CRISPR/Cas9 peuvent remodeler de manière ciblée des loci endogènes, transformant des fibroblastes en cellules neuronales. Cette capacité à reprogrammer les cellules a des implications majeures pour la médecine régénérative.
Conclusion
L’édition épigénétique, soutenue par les technologies CRISPR, représente une frontière passionnante de la recherche biomédicale. Avec des avancées continues et des applications potentielles dans le traitement de maladies, cette discipline est en passe de redéfinir notre approche de la biologie et de la médecine. Les recherches en cours promettent d’élargir encore les horizons de ce domaine dynamique.
Édition Épigénétique : Une Révolution dans la Biologie Moléculaire
Introduction à l’Édition Épigénétique
L’édition épigénétique représente une avancée majeure dans le domaine de la biologie moléculaire, permettant de modifier l’expression des gènes sans altérer la séquence d’ADN sous-jacente. Cette technique offre des perspectives prometteuses pour la recherche biomédicale et le traitement de diverses maladies.
Les Outils de l’Édition Épigénétique
CRISPR et ses Applications
Le système CRISPR, initialement découvert comme un mécanisme de défense chez les bactéries, a été adapté pour l’édition génétique. Des études récentes, comme celle de Nunez et al. (2021), ont démontré que l’édition épigénétique basée sur CRISPR peut induire une mémoire transcriptionnelle programmable à l’échelle du génome. Cela ouvre la voie à des applications thérapeutiques innovantes.
Activateurs Transcriptionnels
Des recherches menées par Alerasool et al. (2020) ont mis en lumière l’efficacité des domaines KRAB dans les applications CRISPRi, soulignant leur potentiel pour réguler l’expression génique dans les cellules humaines. Ces activateurs transcriptionnels sont essentiels pour la manipulation précise des réseaux génétiques.
Mécanismes de Régulation Épigénétique
Silençage Génétique Héritable
L’étude d’Amabile et al. (2016) a révélé que le silencage héritable des gènes endogènes peut être réalisé par des techniques d’édition épigénétique ciblée. Ce type de modification pourrait avoir des implications significatives pour la recherche sur les maladies génétiques et le développement de traitements.
Dynamique de la Régulation Épigénétique
La recherche de Bintu et al. (2016) a exploré la dynamique de la régulation épigénétique au niveau des cellules individuelles, fournissant des informations cruciales sur la manière dont les modifications épigénétiques influencent l’expression génique dans des contextes variés.
Perspectives Futures
Édition Épigénétique et Thérapies Génétiques
Avec des études comme celle de Cappelluti et al. (2024), qui montrent un silençage génique durable et efficace in vivo, l’édition épigénétique pourrait transformer les approches thérapeutiques pour des maladies complexes. Les chercheurs s’orientent vers des stratégies qui intègrent l’édition épigénétique dans les traitements de maladies comme le cancer et les troubles neurodégénératifs.
Défis et Considérations Éthiques
Malgré les avancées, des défis subsistent, notamment en ce qui concerne la sécurité et l’éthique de l’édition épigénétique. Les implications de ces technologies sur la santé humaine et l’environnement nécessitent une évaluation rigoureuse pour garantir leur utilisation responsable.
Conclusion
L’édition épigénétique est en train de redéfinir notre compréhension de la biologie et de la médecine. Avec des outils comme CRISPR et des découvertes récentes sur les mécanismes de régulation, cette discipline promet de révolutionner le traitement des maladies et d’ouvrir de nouvelles voies pour la recherche scientifique. Les prochaines années seront cruciales pour explorer pleinement le potentiel de ces technologies tout en abordant les questions éthiques qui en découlent.
Édition Épigénétique : Innovations et Perspectives
Introduction à l’Édition Épigénétique
L’édition épigénétique est une technique révolutionnaire qui permet de modifier les marques épigénétiques sur l’ADN, influençant ainsi l’expression des gènes sans altérer la séquence génétique elle-même. Cette approche a des implications significatives dans la recherche biomédicale, notamment pour le traitement de maladies génétiques et le cancer.
Méthodes d’Édition Épigénétique
Utilisation de dCas9
L’une des méthodes les plus prometteuses repose sur l’utilisation de la protéine dCas9, qui est une version modifiée de la protéine Cas9, incapable de couper l’ADN. Cette protéine peut être fusionnée avec des domaines catalytiques, permettant ainsi de cibler spécifiquement des régions de l’ADN pour des modifications épigénétiques.
Exemples de Recherche
Des études récentes ont démontré l’efficacité de dCas9 dans la déméthylation de l’ADN. Par exemple, Morita et al. (2016) ont utilisé des fusions de dCas9 avec des peptides pour cibler la déméthylation de l’ADN in vivo, montrant des résultats prometteurs dans la régulation de l’expression génique.
Édition de la Méthylation de l’ADN
D’autres recherches, comme celles de Lei et al. (2017), ont exploré l’utilisation de dCas9 pour induire la méthylation de l’ADN, ouvrant la voie à des applications potentielles dans le contrôle de l’expression des gènes associés à des maladies.
Applications Cliniques
Traitement des Maladies Génétiques
L’édition épigénétique pourrait transformer le traitement des maladies génétiques. Par exemple, Adhikari et al. (2021) ont démontré une amélioration fonctionnelle dans un modèle de syndrome d’Angelman après traitement avec des cellules souches hématopoïétiques modifiées par lentivirus.
Recherche sur le Cancer
L’édition épigénétique est également explorée dans le contexte du cancer. Des études ont montré que la modification des marques épigénétiques sur des gènes spécifiques peut influencer la progression tumorale, offrant de nouvelles stratégies thérapeutiques.
Défis et Perspectives Futures
Précision et Sélectivité
Un des principaux défis de l’édition épigénétique est d’assurer la précision et la sélectivité des modifications. Des recherches, comme celles de Ford et al. (2018), ont mis en évidence des systèmes modulaires qui réduisent l’activité hors cible, améliorant ainsi la sécurité des interventions.
Intégration dans la Pratique Clinique
L’intégration de ces technologies dans la pratique clinique nécessite encore des études approfondies pour évaluer leur efficacité et leur sécurité à long terme. Les recherches multicentriques, comme celles menées par Yao et al. (2024), sont essentielles pour établir des protocoles standardisés.
Conclusion
L’édition épigénétique représente une avancée majeure dans le domaine de la biologie moléculaire et de la médecine. Avec des recherches continues et des innovations technologiques, cette approche pourrait offrir des solutions nouvelles et efficaces pour traiter diverses maladies, transformant ainsi le paysage de la médecine moderne.
Exploration des Écrans CRISPR et de la Reprogrammation Cellulaire
Introduction à la Reprogrammation Cellulaire
La reprogrammation cellulaire est un domaine de recherche en pleine expansion, permettant de transformer des cellules différenciées en cellules pluripotentes. Cette technique offre des perspectives prometteuses pour la médecine régénérative et le traitement de diverses maladies. Les écrans CRISPR, en particulier, jouent un rôle crucial dans l’identification des facteurs régulateurs de cette reprogrammation.
Identification des Facteurs Régulateurs
Des études récentes ont mis en lumière plusieurs régulateurs clés de la destinée neuronale grâce à des écrans d’activation CRISPR. Par exemple, une recherche menée par Liu et al. a révélé des éléments essentiels qui influencent la reprogrammation neuronale, soulignant l’importance de ces outils dans la compréhension des mécanismes sous-jacents à la différenciation cellulaire.
Nouveaux Avancées dans la Recherche
Des travaux menés par Black et al. ont identifié des régulateurs maîtres de la spécification des cellules neuronales humaines. Ces découvertes, publiées dans Cell Reports, montrent comment les écrans CRISPR peuvent être utilisés pour déchiffrer les complexités de la biologie cellulaire.
Écrans CRISPR à Grande Échelle
L’étude de Yang et al. a démontré l’efficacité des écrans CRISPR à l’échelle du génome pour identifier de nouveaux facteurs impliqués dans la reprogrammation cellulaire. Ces résultats ouvrent la voie à des approches innovantes pour manipuler les voies de signalisation cellulaire.
Rôle des Protéines Mitochondriales
Une recherche menée par Coukos et al. a mis en évidence l’importance des protéines de localisation dans le trafic des membranes mitochondriales et du réticulum endoplasmique. Ces découvertes, obtenues grâce à des écrans CRISPRi, soulignent le potentiel de cette technologie pour explorer des mécanismes complexes au sein des cellules.
Transport des Dinucleotides Cycliques
L’étude de Luteijn et al. a révélé que le transporteur SLC19A1 joue un rôle crucial dans le transport des dinucléotides cycliques immunoréactifs. Cette découverte, publiée dans Nature, illustre comment les écrans CRISPR peuvent contribuer à la compréhension des processus biologiques fondamentaux.
Découvertes dans les Microglies
Drager et al. ont utilisé une plateforme CRISPRi/a pour explorer les régulateurs des états pathologiques dans les microglies dérivées de cellules souches pluripotentes induites (iPSC). Cette recherche met en lumière l’application des technologies CRISPR dans l’étude des maladies neurodégénératives.
Lien entre Défaillance Lysosomale et Ferroptose
Une étude récente de Tian et al. a établi un lien entre la défaillance lysosomale et la ferroptose dans les neurones humains, démontrant l’impact des écrans CRISPR sur la compréhension des mécanismes de la mort cellulaire.
Identification des ARN Longs Non Codants
Liu et al. ont utilisé une approche CRISPRi pour identifier des loci fonctionnels d’ARN longs non codants dans les cellules humaines. Cette recherche souligne l’importance croissante des ARN non codants dans la régulation génétique.
Annotation des ADN Régulateurs
Klann et al. ont proposé des méthodes basées sur CRISPR pour l’annotation à haut débit de l’ADN régulateur, ouvrant de nouvelles avenues pour la recherche en biotechnologie.
Conclusion
Les écrans CRISPR représentent un outil puissant pour explorer les mécanismes de la reprogrammation cellulaire et de la différenciation. Les avancées récentes dans ce domaine promettent de transformer notre compréhension des processus biologiques et d’ouvrir la voie à de nouvelles thérapies pour diverses maladies.
La Reprogrammation Cellulaire : Un Aperçu des Avancées Récentes
Introduction à la Reprogrammation Cellulaire
La reprogrammation cellulaire est un domaine de recherche en pleine expansion qui vise à transformer un type cellulaire en un autre, offrant ainsi des perspectives prometteuses pour la médecine régénérative et le traitement de diverses maladies. Grâce à des techniques innovantes, les scientifiques parviennent à générer des cellules fonctionnelles à partir de cellules souches pluripotentes humaines, ouvrant la voie à des applications thérapeutiques.
Techniques de Reprogrammation
Induction de Neurones Fonctionnels
Une étude marquante a démontré qu’il est possible d’obtenir des neurones fonctionnels à partir de cellules souches pluripotentes humaines en une seule étape. Cette avancée, publiée dans Neuron, souligne l’efficacité des méthodes actuelles pour générer des cellules neuronales, essentielles pour traiter des maladies neurodégénératives.
Ingénierie des Tissus Musculaires
Des chercheurs ont réussi à transformer des cellules souches pluripotentes en tissus musculaires squelettiques fonctionnels. Cette innovation, rapportée dans Nature Communications, pourrait révolutionner les traitements pour les maladies musculaires, en permettant la régénération de tissus endommagés.
Approches Innovantes
Conversion Directe de Fibroblastes
Une autre avancée significative a été la conversion directe de fibroblastes en neurones fonctionnels grâce à des facteurs spécifiques. Cette méthode, décrite dans Nature, offre une alternative prometteuse pour la création de cellules neuronales sans passer par un état pluripotent.
Identification des Facteurs de Transcription
Un travail systématique a été réalisé pour identifier les facteurs de transcription qui régulent l’identité cellulaire. Cette recherche, publiée dans Stem Cell Reports, est cruciale pour comprendre comment manipuler les cellules pour obtenir des types cellulaires spécifiques.
Outils et Méthodes de Prédiction
CellNet et Cell Fate Conversion
L’utilisation de CellNet a permis d’analyser les types cellulaires ingénierés et d’améliorer la conversion des cellules. Cette approche, présentée dans Cell, démontre l’importance des outils computationnels dans la reprogrammation cellulaire.
Approches Basées sur les Réseaux
Des outils comme ANANSE, qui se basent sur des réseaux d’activateurs, ont été développés pour prédire les facteurs de transcription clés dans la détermination du destin cellulaire. Cette méthode, décrite dans Nucleic Acids Research, représente une avancée majeure dans la compréhension des mécanismes de reprogrammation.
Perspectives Futures
Atlas des Facteurs de Transcription
Un atlas des facteurs de transcription pour la différenciation dirigée a été récemment publié, fournissant une ressource précieuse pour les chercheurs. Cette base de données, présentée dans Cell, pourrait faciliter le développement de nouvelles thérapies basées sur la reprogrammation cellulaire.
Bibliothèque Complète de Facteurs de Transcription
Une bibliothèque exhaustive de facteurs de transcription humains a été mise en place pour l’ingénierie du destin cellulaire. Cette initiative, rapportée dans Nature Biotechnology, pourrait accélérer les découvertes dans le domaine de la biologie cellulaire.
Conclusion
La reprogrammation cellulaire est un domaine dynamique qui continue d’évoluer rapidement. Les avancées récentes dans les techniques de conversion cellulaire et l’identification des facteurs de transcription ouvrent de nouvelles voies pour la recherche biomédicale. Avec des applications potentielles dans le traitement de maladies variées, il est essentiel de poursuivre les efforts dans ce domaine prometteur.
Révolution dans la Reprogrammation Cellulaire : Les Avancées des Techniques CRISPR
Introduction à la Reprogrammation Cellulaire
La reprogrammation cellulaire est un domaine de recherche en pleine expansion, permettant de transformer des cellules différenciées en cellules pluripotentes. Cette capacité offre des perspectives prometteuses pour la médecine régénérative et le traitement de diverses maladies. Des études récentes ont mis en lumière l’importance des modifications chromatiniennes dans la reprogrammation des loci endogènes tels que Oct4 et Sox2.
Techniques Innovantes de Reprogrammation
Des chercheurs, comme Balboa et al. (2015), ont développé des activateurs dCas9 conditionnellement stabilisés, permettant un contrôle précis de l’expression génique lors de la reprogrammation et de la différenciation des cellules humaines. Cette approche ouvre la voie à des manipulations génétiques plus ciblées et efficaces.
Utilisation de CRISPR pour la Conversion Cellulaire
L’utilisation de CRISPR pour convertir des cellules souches embryonnaires en lignées extraembryonnaires a été démontrée par Wei et al. (2016). Cette technique innovante permet de mieux comprendre les mécanismes de développement et d’identifier de nouvelles voies thérapeutiques.
Comparaison des Facteurs de Transcription
Gao et al. (2013) ont exploré l’utilisation de facteurs de transcription TALE conçus pour cibler des amplificateurs, démontrant leur efficacité dans la reprogrammation vers la pluripotence. Une étude ultérieure a comparé ces facteurs avec le système CRISPR/dCas9, soulignant les avantages et les inconvénients de chaque méthode dans la régulation de l’expression génique.
Cartographie des Amplificateurs Fonctionnels
Des travaux récents, comme ceux de Fulco et al. (2016), ont permis de cartographier systématiquement les connexions fonctionnelles entre amplificateurs et promoteurs à l’aide de l’interférence CRISPR. Cette approche a révélé des insights précieux sur la régulation génique et les interactions complexes au sein du génome.
Identification des Éléments Régulateurs
D’autres études, telles que celles de Gasperini et al. (2017), ont utilisé des suppressions génomiques programmées pour identifier les éléments régulateurs nécessaires à l’expression de gènes spécifiques. Ces recherches sont essentielles pour comprendre comment les variations génétiques peuvent influencer les maladies humaines.
Conclusion
Les avancées dans le domaine de la reprogrammation cellulaire, notamment grâce aux techniques CRISPR, continuent de transformer notre compréhension de la biologie cellulaire. Ces innovations ouvrent des perspectives passionnantes pour le développement de nouvelles thérapies et la compréhension des mécanismes sous-jacents aux maladies. Les recherches en cours promettent d’approfondir encore davantage nos connaissances et d’améliorer les traitements futurs.
Exploration des Éléments Régulateurs dans le Génome Humain
Introduction aux Écrans Génétiques Fonctionnels
Les avancées récentes dans le domaine de la biotechnologie ont permis de mieux comprendre les éléments régulateurs du génome humain. Des études utilisant la technologie CRISPR-Cas9 ont été essentielles pour identifier et caractériser ces éléments, qui jouent un rôle crucial dans la régulation des gènes.
Cartographie des ADN Régulateurs
Une étude menée par Rajagopal et al. a mis en lumière la cartographie à haut débit de l’ADN régulateur, révélant des informations précieuses sur la manière dont ces séquences influencent l’expression génique. Cette recherche a été publiée dans Nature Biotechnology et a ouvert la voie à de nouvelles méthodes d’analyse génétique.
Interrogation des Éléments Fonctionnels
Sanjana et ses collègues ont réalisé une enquête approfondie sur les éléments fonctionnels présents dans le génome non codant. Leur travail, publié dans Science, a permis de mieux comprendre les mécanismes sous-jacents à la régulation génique, en se concentrant sur les régions souvent négligées du génome.
Découverte des Améliorateurs et de leur Rôle dans le Cancer
Une recherche récente de Chen et al. a systématiquement découvert et analysé les améliorateurs nécessaires à la survie et à la prolifération des cellules cancéreuses. Cette étude, parue dans Cell Reports, souligne l’importance des éléments régulateurs dans le développement des cancers et pourrait ouvrir de nouvelles voies pour des thérapies ciblées.
Modèle d’Activité par Contact
Fulco et al. ont proposé un modèle d’interaction entre les améliorateurs et les promoteurs basé sur des milliers de perturbations CRISPR. Leur étude, publiée dans Nature Genetics, a permis de mieux comprendre comment ces interactions régulent l’expression des gènes dans divers contextes cellulaires.
Caractérisation Directe des Éléments Régulateurs
Reilly et ses collaborateurs ont développé une méthode pour caractériser directement les éléments cis-régulateurs et disséquer des associations génétiques complexes. Leur recherche, parue dans Nature Genetics, a démontré l’efficacité de l’approche HCR-FlowFISH pour analyser les circuits régulateurs.
Identification des Améliorateurs Immunitaires
Simeonov et al. ont découvert des améliorateurs immunitaires sensibles à la stimulation grâce à l’activation CRISPR. Cette étude, publiée dans Nature, met en évidence l’importance des éléments régulateurs dans la réponse immunitaire et leur potentiel en tant que cibles thérapeutiques.
Décodage Systématique de la Régulation Génétique
Mowery et ses collègues ont réalisé un décodage systématique de la régulation génétique, définissant le contrôle contextuel du locus des récepteurs co-stimulateurs multi-gènes dans les cellules T humaines. Leur étude récente dans Nature Genetics a des implications significatives pour la compréhension des réponses immunitaires.
Approches Innovantes en Profilage Cellulaire
Des techniques telles que le Perturb-seq, développées par Dixit et al., permettent de disséquer les circuits moléculaires à l’aide d’un profilage RNA à cellule unique. Cette méthode, publiée dans Cell, offre une nouvelle perspective sur l’analyse des écrans génétiques.
Conclusion
Les recherches sur les éléments régulateurs du génome humain continuent d’évoluer, avec des implications majeures pour la biologie cellulaire et la médecine. Les avancées technologiques, notamment l’utilisation de CRISPR, ouvrent de nouvelles avenues pour la compréhension des mécanismes régulateurs et leur impact sur la santé humaine.
Innovations en Édition Génétique et Thérapies Cellulaires
Introduction à l’Édition Génétique
L’édition génétique a connu des avancées significatives ces dernières années, notamment grâce à des techniques comme CRISPR-Cas9. Cette méthode révolutionnaire permet de modifier des séquences d’ADN avec une précision sans précédent, ouvrant la voie à des traitements potentiels pour des maladies génétiques telles que la drépanocytose et la bêta-thalassémie.
Études Récentes et Découvertes
Une étude récente menée par Yao et al. (2023) a exploré le criblage génétique à grande échelle pour les circuits régulateurs, utilisant une méthode appelée Perturb-seq. Cette approche innovante permet d’analyser les interactions complexes entre les gènes et leur environnement, fournissant des informations précieuses sur la régulation génétique.
De plus, Klann et ses collègues (2021) ont réalisé une annotation à l’échelle du génome des éléments régulateurs des gènes, mettant en lumière leur lien avec la viabilité cellulaire. Ces découvertes sont essentielles pour comprendre comment les cellules s’adaptent à divers stress environnementaux.
Mécanismes de Réponse Cellulaire
Les chercheurs, comme Cosgrove et al. (2024), ont également étudié comment les enhancers génomiques sensibles à la mécanique influencent la réponse cellulaire à la rigidité de la matrice. Ces travaux soulignent l’importance de l’environnement physique sur le comportement cellulaire, ce qui pourrait avoir des implications pour le développement de thérapies ciblées.
Applications Cliniques de l’Édition Génétique
L’application clinique de l’édition génétique est illustrée par les travaux de Frangoul et al. (2021), qui ont utilisé CRISPR-Cas9 pour traiter des patients atteints de drépanocytose. Les résultats prometteurs de cette étude ouvrent la voie à des traitements potentiels pour d’autres maladies génétiques.
Une étude antérieure par Uda et al. (2008) a identifié le gène BCL11A comme un facteur clé associé à la production d’hémoglobine fœtale, offrant une cible potentielle pour des interventions thérapeutiques.
Perspectives d’Avenir
Les recherches sur les facteurs de transcription artificiels, comme celles menées par Graslund et al. (2005), visent à concevoir des outils capables d’induire l’expression de gènes spécifiques, tels que le gène de la globine gamma, pour traiter des maladies comme la drépanocytose. Ces stratégies pourraient transformer le paysage des traitements génétiques.
Conclusion
L’édition génétique et les thérapies cellulaires continuent d’évoluer rapidement, avec des études récentes qui mettent en lumière des mécanismes complexes et des applications cliniques prometteuses. À mesure que la recherche progresse, il est essentiel de suivre ces développements pour comprendre leur impact potentiel sur la médecine moderne.
Dynamique Cellulaire et Thérapie CAR-T : Une Révolution en Cours
Introduction à la Thérapie CAR-T
La thérapie CAR-T, qui utilise des cellules T génétiquement modifiées pour cibler et détruire les cellules cancéreuses, a transformé le paysage du traitement des lymphomes et des leucémies. Cette approche innovante a montré des résultats prometteurs, notamment chez les patients qui ne répondent pas aux traitements conventionnels.
Mécanismes de Réaction des Cellules T
Réponse Cellulaire Distincte
Des études récentes, comme celle de Haradhvala et al. (2022), ont mis en lumière les dynamiques cellulaires uniques qui se manifestent lors de la réponse à la thérapie CAR-T pour les lymphomes B réfractaires. Ces recherches soulignent l’importance de comprendre comment les cellules T interagissent avec leur environnement tumoral pour optimiser les résultats cliniques.
Reconnaissance Précise des Tumeurs
Roybal et ses collègues (2016) ont démontré que des circuits de détection d’antigènes combinatoires permettent aux cellules T de reconnaître les tumeurs avec une précision accrue. Cette avancée pourrait ouvrir la voie à des traitements plus ciblés et efficaces.
Innovations dans la Conception des Récepteurs
Récepteurs Synthétiques Modulaire
Zhu et al. (2022) ont proposé un design modulaire pour des récepteurs synthétiques, facilitant la régulation génétique programmée dans les thérapies cellulaires. Cette approche pourrait améliorer la flexibilité et l’efficacité des traitements CAR-T.
Reconnaissance Antigénique Combinatoire
Kloss et al. (2013) ont mis en avant l’importance d’une reconnaissance antigénique combinatoire avec un signal équilibré, favorisant l’éradication sélective des tumeurs par des cellules T modifiées. Cette stratégie pourrait réduire les effets secondaires tout en augmentant l’efficacité thérapeutique.
Résistance à l’Épuisement des Cellules T
Surexpression de c-Jun
Lynn et al. (2019) ont révélé que la surexpression de c-Jun dans les cellules CAR-T confère une résistance à l’épuisement, un obstacle majeur dans le traitement du cancer. Cette découverte pourrait mener à des stratégies pour prolonger l’activité des cellules T dans le temps.
Coopération de BATF et IRF4
Seo et al. (2021) ont identifié que les facteurs BATF et IRF4 collaborent pour contrer l’épuisement des cellules CAR-T infiltrant les tumeurs. Comprendre ces mécanismes pourrait aider à développer des thérapies plus durables.
Exploration Génétique et Épigénétique
Écrans CRISPR à Grande Échelle
Des recherches récentes, comme celles de McCutcheon et al. (2023), ont utilisé des écrans CRISPR pour identifier des régulateurs transcriptionnels et épigénétiques de la fonction des cellules T CD8+. Ces découvertes sont essentielles pour comprendre les voies de signalisation qui influencent l’efficacité des thérapies CAR-T.
Sensibilité Antigénique Améliorée
Carnevale et al. (2022) ont montré que l’ablation de RASA2 dans les cellules T augmente la sensibilité aux antigènes et améliore la fonction à long terme. Cette approche pourrait être cruciale pour le développement de traitements plus efficaces.
Conclusion
La thérapie CAR-T continue d’évoluer grâce à des recherches innovantes qui explorent les mécanismes sous-jacents de la réponse immunitaire. En intégrant des approches modulaires et en ciblant des voies spécifiques, il est possible d’améliorer l’efficacité et la durabilité des traitements, offrant ainsi de nouvelles perspectives aux patients atteints de cancers réfractaires.
Innovations dans la thérapie CAR T : Vers une efficacité accrue
Introduction à la thérapie CAR T
La thérapie CAR T, qui utilise des cellules T génétiquement modifiées pour cibler et détruire les cellules cancéreuses, a révolutionné le traitement de certains types de cancers. Cependant, des défis subsistent, notamment l’épuisement des cellules T et la réponse limitée dans les tumeurs solides. Des recherches récentes se concentrent sur l’amélioration de l’efficacité de cette approche prometteuse.
Avancées dans la recherche sur les cellules T
Prévenir l’épuisement des cellules T
Une étude menée par Prinzing et al. a démontré que la suppression du gène DNMT3A dans les cellules CAR T peut prévenir leur épuisement, augmentant ainsi leur activité antitumorale. Cette découverte ouvre la voie à des stratégies visant à maintenir la vitalité des cellules T dans le microenvironnement tumoral.
Facteurs de transcription et leur impact
Les facteurs de transcription NR4A ont été identifiés comme des régulateurs clés limitant la fonction des cellules CAR T dans les tumeurs solides, selon les travaux de Chen et al. En ciblant ces facteurs, il pourrait être possible d’améliorer la réponse des cellules T dans des contextes tumoraux difficiles.
Innovations technologiques : CRISPR et cellules T
Utilisation de CRISPR pour améliorer l’efficacité
Des recherches récentes ont utilisé la technologie CRISPR pour identifier des gènes qui influencent la persistance des cellules T. Par exemple, une étude a révélé que la disruption de TET2 améliore l’efficacité des cellules T ciblant CD19, ce qui pourrait avoir des implications significatives pour le traitement des leucémies.
Évaluation des effets des modifications génétiques
Une étude de Stadtmauer et al. a exploré l’utilisation de cellules T modifiées par CRISPR chez des patients atteints de cancers réfractaires. Les résultats ont montré une réponse prometteuse, soulignant le potentiel de cette technologie pour surmonter les obstacles actuels en oncologie.
Perspectives d’avenir
Reprogrammation contextuelle des cellules CAR T
La recherche sur la reprogrammation des cellules CAR T en fonction du contexte tumoral est en plein essor. Yang et al. ont démontré que des ajustements spécifiques pouvaient améliorer l’efficacité des cellules CAR T dans le traitement des cancers HER2 positifs, suggérant que des approches personnalisées pourraient devenir la norme.
Importance de la dynamique des enhancers
Les travaux de He et al. ont mis en lumière l’importance des répertoires d’enhancers dynamiques dans la réponse des cellules T aux infections. Comprendre ces mécanismes pourrait permettre d’optimiser les thérapies CAR T en adaptant les circuits régulateurs des cellules T.
Conclusion
Les avancées dans la recherche sur les cellules T et la thérapie CAR T ouvrent de nouvelles avenues pour le traitement du cancer. En ciblant les mécanismes d’épuisement, en utilisant des technologies comme CRISPR et en adaptant les traitements aux spécificités des tumeurs, il est possible d’améliorer considérablement l’efficacité de ces thérapies. L’avenir de la médecine oncologique semble prometteur, avec des innovations qui pourraient transformer la prise en charge des patients.
Les Avancées dans la Recherche Génétique
Introduction à la Génétique et à ses Implications
La génétique est un domaine en pleine expansion qui joue un rôle crucial dans notre compréhension des maladies humaines. Les recherches récentes mettent en lumière l’importance des variations génétiques et de leur impact sur la santé. Des études ont démontré que des anomalies dans des gènes spécifiques peuvent entraîner des maladies graves, soulignant ainsi la nécessité d’une exploration approfondie de la génétique humaine.
L’Impact de la Perte ou du Gain de Fonction des Gènes
Une étude menée par Na et al. (2013) a examiné comment la perte ou le gain de fonction du gène MeCP2 influence la plasticité synaptique. Cette recherche a révélé que les modifications de ce gène peuvent avoir des conséquences significatives sur le fonctionnement neuronal, ce qui pourrait être lié à des troubles neurodéveloppementaux.
Maladies Génétiques et Surexpression des Gènes
La surexpression du gène PKD1 a été identifiée comme un facteur clé dans le développement de la maladie polykystique des reins, selon Thivierge et ses collègues (2006). Cette découverte souligne l’importance de la régulation des gènes dans la prévention des maladies héréditaires.
Sensibilité à la Dosage et Pathogénicité
Rice et McLysaght (2017) ont mis en évidence que la sensibilité au dosage est un déterminant majeur de la pathogénicité des variants de nombre de copies chez l’homme. Cela signifie que même de petites variations dans le nombre de copies d’un gène peuvent avoir des effets dramatiques sur la santé.
Épigénétique et Maladies Humaines
L’épigénétique joue également un rôle crucial dans la régulation des gènes. Moss et Wallrath (2007) ont exploré les liens entre le silence épigénétique des gènes et les maladies humaines, suggérant que des modifications épigénétiques peuvent contribuer à l’apparition de diverses pathologies.
Caractérisation de l’Haploinsuffisance
Huang et al. (2010) ont caractérisé l’haploinsuffisance dans le génome humain, une condition où une seule copie d’un gène est insuffisante pour maintenir une fonction normale. Cette recherche est essentielle pour comprendre les bases génétiques de nombreuses maladies.
Identification des Gènes Haploinsuffisants
Une étude par Dang et al. (2008) a permis d’identifier des gènes humains haploinsuffisants et leur proximité génomique avec des duplications segmentaires. Ces découvertes ouvrent la voie à de nouvelles stratégies pour le diagnostic et le traitement des maladies génétiques.
Cas de Maladies Familiales
Freischmidt et al. (2015) ont démontré que l’haploinsuffisance du gène TBK1 est responsable de la sclérose latérale amyotrophique familiale et de la démence frontotemporale. Cette recherche met en lumière l’importance de l’analyse génétique dans le cadre des maladies neurodégénératives.
Innovations en Édition Génétique
Les avancées technologiques, telles que l’utilisation de Cas9 de Staphylococcus aureus pour l’édition génomique in vivo (Ran et al., 2015), ont révolutionné le domaine de la biologie moléculaire. De plus, des systèmes CRISPR-Cas miniaturisés ont été développés pour une régulation et une édition plus efficaces du génome (Xu et al., 2021).
Conclusion
Les recherches en génétique continuent de progresser rapidement, offrant de nouvelles perspectives sur la compréhension et le traitement des maladies humaines. Les découvertes récentes soulignent l’importance de la génétique dans la médecine moderne et ouvrent la voie à des approches innovantes pour la prévention et le traitement des maladies.
Innovations en Édition Génétique : Un Aperçu des Avancées Récentes
Introduction à l’Édition Génétique
L’édition génétique a connu des avancées significatives ces dernières années, notamment grâce à des technologies comme CRISPR/Cas9. Ces outils permettent de modifier des séquences d’ADN avec une précision sans précédent, ouvrant la voie à des traitements potentiels pour diverses maladies génétiques.
Applications de CRISPR/Cas9 dans la Médecine
Spécification des Lignées Cellulaires
Une étude menée par Kwon et al. a démontré comment les activateurs transcriptionnels basés sur CRISPR/Cas9 peuvent influencer la spécification des lignées de cellules progénitrices myogéniques. Cette recherche, publiée dans Stem Cell Reports, souligne l’importance de ces technologies dans le développement de thérapies cellulaires.
Induction de l’Angiogenèse
Rebar et ses collègues ont exploré l’induction de l’angiogenèse dans un modèle murin en utilisant des facteurs de transcription conçus. Leur travail, publié dans Nature Medicine, a montré que ces approches pourraient être cruciales pour traiter des maladies liées à la circulation sanguine.
Neuroprotection et Thérapies Géniques
Expression du Facteur de Croissance Endothélial Vasculaire
Sakowski et al. ont utilisé la thérapie génique pour induire l’expression du facteur de croissance endothélial vasculaire-A, offrant une protection neuroprotectrice. Cette étude, parue dans Gene Therapy, met en lumière le potentiel de la thérapie génique dans le traitement des troubles neurologiques.
Édition de l’ADN pour le Syndrome de Dravet
Des recherches récentes ont montré que l’activation du gène Scn1a à l’aide de dCas9 peut restaurer l’excitabilité des interneurones inhibiteurs et réduire les crises chez des souris modèles du syndrome de Dravet. Cette avancée, rapportée dans Molecular Therapy, pourrait ouvrir de nouvelles voies pour le traitement de cette maladie.
Édition Épigénétique et Maladies Neurodéveloppementales
Syndrome de l’X Fragile
Une étude menée par Liu et al. a révélé que l’édition de la méthylation de l’ADN du gène FMR1 pourrait sauver les neurones affectés par le syndrome de l’X fragile. Cette recherche, publiée dans Cell, souligne l’importance de l’édition épigénétique dans le traitement des troubles neurodéveloppementaux.
Syndrome de Rett
Qian et ses collaborateurs ont démontré que l’édition épigénétique multiplexe du gène MECP2 pouvait restaurer la fonction neuronale chez des modèles de syndrome de Rett. Leur étude, parue dans Science Translational Medicine, illustre le potentiel de ces techniques pour corriger des anomalies génétiques.
Conclusion
Les avancées dans le domaine de l’édition génétique et épigénétique offrent des perspectives prometteuses pour le traitement de diverses maladies. Les recherches en cours continuent de démontrer le potentiel de ces technologies pour transformer la médecine moderne, en apportant des solutions innovantes aux défis de la santé.
Innovations en Thérapie Génique : Vers de Nouvelles Frontières
Introduction à la Thérapie Génique
La thérapie génique représente une avancée majeure dans le domaine médical, offrant des solutions potentielles pour traiter des maladies génétiques et acquises. Grâce à des techniques innovantes comme CRISPR, les chercheurs explorent des méthodes pour modifier les gènes de manière ciblée, ouvrant ainsi la voie à des traitements plus efficaces.
Les Progrès de CRISPR dans la Thérapie Génique
Régulation Génétique Ciblée
Des études récentes ont démontré l’efficacité de la thérapie génique utilisant CRISPR pour réguler des gènes spécifiques. Par exemple, une recherche menée par Moreno et al. a montré comment la thérapie génique in situ peut moduler l’expression des gènes, offrant des perspectives prometteuses pour le traitement de la douleur chronique.
Activation des Gènes Cibles
L’activation des gènes cibles par des techniques de modulation épigénétique a également été mise en avant. Liao et ses collègues ont illustré comment la technologie CRISPR/Cas9 peut être utilisée pour activer des gènes in vivo, ce qui pourrait transformer notre approche des maladies héréditaires.
Applications Cliniques de la Thérapie Génique
Lutte Contre les Virus
La thérapie génique ne se limite pas aux maladies génétiques. Des chercheurs comme Zhao et al. ont développé des facteurs de transcription artificiels capables de réprimer des gènes viraux, comme ceux du virus de l’hépatite B, dans des lignées cellulaires humaines. Ces avancées pourraient révolutionner le traitement des infections virales.
Réactivation de l’HIV
La réactivation ciblée de l’HIV latent est un autre domaine d’application prometteur. Des études ont montré que des systèmes d’activateurs transcriptionnels dérivés de CRISPR peuvent efficacement réveiller le virus dormant, offrant une nouvelle stratégie pour éradiquer l’infection.
Perspectives d’Avenir
Immunothérapie et Vaccins
L’activation de gènes endogènes par CRISPR a également des implications dans le domaine de l’immunothérapie. Wang et al. ont démontré que cette approche peut induire une forte réponse immunitaire antitumorale, soulignant le potentiel de CRISPR dans le développement de vaccins contre le cancer.
Développement de Vaccins Neoantigènes
Les vaccins basés sur les néoantigènes émergent comme une nouvelle forme d’immunothérapie. Selon une étude de Peng et al., ces vaccins pourraient offrir des traitements personnalisés pour les patients atteints de cancer, en ciblant spécifiquement les mutations tumorales.
Conclusion
La thérapie génique, en particulier grâce à des technologies comme CRISPR, ouvre de nouvelles avenues pour le traitement de diverses maladies. Les recherches en cours promettent d’améliorer notre compréhension et notre capacité à traiter des conditions auparavant considérées comme incurables. L’avenir de la médecine pourrait bien être façonné par ces innovations révolutionnaires.
Avancées dans l’Activation Génétique : Une Nouvelle Ère de Thérapies
Introduction à l’Activation Génétique
L’activation génétique représente une avancée significative dans le domaine de la biologie moléculaire, offrant des perspectives prometteuses pour le traitement de diverses maladies génétiques. Des études récentes ont démontré l’efficacité de différentes approches pour stimuler l’expression de gènes spécifiques, ouvrant la voie à des thérapies innovantes.
Techniques d’Activation Génétique
Utilisation de Protéines Électeurs de Transcription
Des recherches menées par Tremblay et al. (2012) ont mis en lumière l’impact des protéines effectrices de type activateur sur l’expression du gène frataxine. Cette découverte souligne l’importance de ces protéines dans la régulation génétique, particulièrement dans le contexte de maladies comme l’ataxie de Friedreich.
Facteurs de Transcription Synthétiques
Une étude de Erwin et al. (2017) a révélé que des facteurs de transcription synthétiques peuvent faciliter la transcription à travers des chromatines répressives. Cette approche pourrait transformer notre compréhension des mécanismes de régulation génétique et offrir de nouvelles stratégies pour surmonter les obstacles liés à la transcription.
Applications Cliniques
Traitement de Maladies Neurodégénératives
L’activation sélective de l’allèle muté du gène HTT a été explorée par Zeitler et al. (2019) comme une stratégie potentielle pour traiter la maladie de Huntington. En ciblant spécifiquement l’allèle défectueux, cette méthode pourrait réduire les effets néfastes de la mutation tout en préservant la fonction normale du gène.
Répression Persistante des Protéines Causant des Maladies
Wegmann et al. (2021) ont démontré qu’il est possible de réprimer de manière persistante l’expression de la protéine tau dans le cerveau en utilisant des facteurs de transcription à doigt de zinc. Cette approche pourrait offrir une nouvelle voie pour traiter des maladies comme la maladie d’Alzheimer, où l’accumulation de tau est un facteur clé.
Innovations Technologiques
CRISPR et Activation Génétique
L’utilisation de la technologie CRISPR pour activer simultanément plusieurs gènes dans le cerveau a été mise en avant par Zhou et al. (2018). Cette méthode innovante permet une manipulation génétique précise et pourrait révolutionner le traitement de diverses pathologies neurologiques.
Évaluation des Régulateurs de Régénération Hépatique
Une étude récente par Jia et al. (2022) a identifié des remodelers de chromatine comme des régulateurs potentiels de la régénération hépatique chez les mammifères. Cette découverte pourrait ouvrir de nouvelles avenues pour le traitement des maladies du foie.
Conclusion
Les avancées dans le domaine de l’activation génétique offrent des perspectives fascinantes pour le traitement de maladies complexes. Grâce à des techniques innovantes et à une meilleure compréhension des mécanismes de régulation, il est possible d’envisager des thérapies ciblées qui pourraient transformer la prise en charge de nombreuses affections. Les recherches en cours continueront d’éclairer ce domaine dynamique et prometteur.
Innovations en Ingénierie Génétique : Une Révolution en Cours
Introduction à l’Ingénierie Génétique
L’ingénierie génétique est un domaine en pleine expansion qui transforme notre compréhension de la biologie et de la médecine. Grâce à des techniques avancées, les scientifiques sont désormais capables de modifier les gènes de manière précise, ouvrant la voie à des traitements innovants pour diverses maladies.
Les Progrès des Outils de Modification Génétique
CRISPR et ses Applications
L’une des avancées les plus significatives dans ce domaine est l’utilisation de la technologie CRISPR-Cas9. Cette méthode permet de cibler et de modifier des séquences spécifiques de l’ADN avec une précision sans précédent. Par exemple, des études récentes ont démontré que des protéines Cas9 orthogonales peuvent être utilisées pour réguler l’expression des gènes de manière contrôlée, ce qui pourrait avoir des implications majeures pour le traitement de maladies génétiques.
Nanoparticules pour la Livraison de Médicaments
Les nanoparticules sont également en train de révolutionner la manière dont les médicaments sont administrés. Des recherches ont montré que des nanoparticules ciblées peuvent transporter des ARN messagers (ARNm) directement vers des tissus spécifiques, améliorant ainsi l’efficacité des traitements. Par exemple, des nanoparticules de tri organique (SORT) ont été développées pour délivrer des ARNm de manière ciblée, facilitant l’édition génétique via CRISPR.
Reprogrammation Cellulaire et Thérapies Avancées
Reprogrammation des Cellules T
Des études récentes ont exploré la reprogrammation des cellules T humaines pour des applications thérapeutiques. En utilisant des véhicules de livraison enveloppés, les chercheurs ont réussi à modifier ces cellules pour qu’elles puissent mieux combattre les maladies, notamment certains types de cancers.
Protéines Thérapeutiques et Particules Virales
L’utilisation de particules virales conçues pour délivrer des protéines thérapeutiques a également montré des résultats prometteurs. Ces particules imitent les virus, mais sont modifiées pour transporter des traitements sans provoquer d’infection, ce qui représente une avancée majeure dans le domaine de la thérapie génique.
Conclusion : Vers un Avenir Prometteur
L’ingénierie génétique continue de progresser à un rythme rapide, avec des applications qui pourraient transformer la médecine moderne. Les innovations telles que CRISPR, les nanoparticules et la reprogrammation cellulaire ouvrent de nouvelles voies pour le traitement de maladies jusqu’alors incurables. Alors que la recherche avance, il est essentiel de suivre ces développements pour comprendre leur impact potentiel sur la santé humaine et la biotechnologie.
Stratégies Innovantes pour l’Activation Génétique avec CRISPR
Introduction à CRISPR et son Impact
La technologie CRISPR, qui a révolutionné le domaine de la biologie moléculaire, permet des modifications précises de l’ADN. En particulier, l’utilisation de Cas9 pour l’activation des gènes a ouvert de nouvelles voies pour la recherche et la thérapie génique. Des études récentes montrent comment cette méthode peut être optimisée pour des applications in vivo, notamment dans des modèles de maladies.
Avancées dans l’Activation Génétique
Études Clés
Une étude menée par Campen et al. (2017) a démontré une stratégie optimisée pour l’activation de Cas9 in vivo dans Drosophila, soulignant l’efficacité de cette approche pour des recherches génétiques avancées. De même, Yamagata et ses collègues (2020) ont utilisé un système CRISPR/dCas9 pour activer le gène Scn1a dans des neurones inhibiteurs, ce qui a permis d’améliorer les phénotypes épileptiques chez des souris modèles du syndrome de Dravet.
Innovations Technologiques
Des chercheurs comme Vora et al. (2018) ont conçu un activateur CRISPR-Cas9 compact pour une livraison médiée par AAV, facilitant ainsi l’application clinique de cette technologie. Par ailleurs, Kojima et al. (2022) ont exploré l’édition de l’épigénome, révélant des mécanismes de contrôle de l’imprinting dans le domaine Dlk1-Dio3.
Applications Cliniques et Perspectives
Récupération de l’Expression Génétique
Une étude de Xu et al. (2018) a mis en évidence comment une méthylation hydroxyméthyl spécifique, basée sur CRISPR/Cas9, peut restaurer l’expression génique et réduire la fibrose rénale. Ces résultats ouvrent des perspectives prometteuses pour le traitement de maladies rénales.
Collaboration entre Protéines
Kim et al. (2015) ont étudié la coopération entre SMYD3 et PC4, révélant un programme transcriptionnel distinct dans les cellules cancéreuses. Cette découverte souligne l’importance des interactions protéiques dans la régulation génique.
Conclusion
La technologie CRISPR continue d’évoluer, avec des recherches qui mettent en lumière son potentiel pour transformer la médecine et la biologie. Les avancées récentes dans l’activation des gènes et l’édition épigénétique ouvrent la voie à de nouvelles thérapies ciblées, offrant des solutions innovantes pour des maladies jusqu’alors difficiles à traiter. Les études en cours et les innovations technologiques promettent de faire de CRISPR un outil incontournable dans la recherche biomédicale.
Désolé, je ne peux pas vous aider avec ça.
Général
Une éruption mystérieuse qui a changé le climat et rendu le soleil bleu : découverte d’une île reculée du Pacifique
Une découverte fascinante a été faite par des chercheurs concernant une éruption volcanique survenue en 1831, qui a modifié le climat et rendu le soleil bleu. En étudiant les cendres dans les carottes de glace polaires, ils ont identifié le Zavaritskii, un volcan isolé des îles Kouriles, comme responsable de cet événement mystérieux. Cette éruption a entraîné un refroidissement climatique de 1 °C, provoquant des famines en Inde et au Japon. William Hutchison, volcanologue à l’Université de St Andrews, souligne que cette découverte révèle encore combien nous ignorons sur l’activité volcanique dans cette région reculée.

Découverte des Origines d’une Éruption Volcanique Historique
Des chercheurs ont récemment élucidé les origines d’une éruption volcanique survenue il y a 200 ans, qui a libéré une quantité massive de soufre dans l’atmosphère, entraînant un changement climatique notable et donnant au soleil une teinte bleue.
Un refroidissement Climatique en 1831
En 1831, la température moyenne dans l’hémisphère nord a chuté d’environ 1,8 degré Fahrenheit (soit environ 1 degré Celsius), coïncidant avec des rapports faisant état de conditions météorologiques sombres et de variations colourées du soleil. Bien que les scientifiques aient établi qu’une éruption volcanique majeure était à l’origine de ce phénomène étrange, le volcan responsable demeurait inconnu jusqu’à présent.
Pistes Découvertes dans les Cœurs Glaciaires
Afin d’identifier la source de cette éruption, les chercheurs ont analysé des cendres retrouvées dans des carottes glaciaires polaires. Leur étude a révélé que l’éruption provenait du volcan Zavaritskii situé sur l’île isolée de Simushir,qui fait partie des îles Kouriles contestées entre la Russie et le Japon. Pendant la guerre froide, l’Union soviétique avait utilisé un cratère volcanique inondé sur Simushir comme base secrète pour sous-marins nucléaires.
Les résultats publiés le 30 décembre 2024 dans la revue PNAS, soulignent combien il reste encore à découvrir concernant l’activité volcanique sur ces îles.
L’impact Météorologique Documenté
« Bien que 1831 soit une période relativement récente, nous n’avions aucune idée que ce volcan était à l’origine [de cette éruption dramatique] », a déclaré William Hutchison, auteur principal et volcanologue à l’Université St Andrews. « C’était complètement hors radar. »
L’éruption de 1831 fait partie d’une série d’éruptions volcaniques au XIXe siècle liées à la phase finale du Petit Âge Glaciaire, qui s’étendait approximativement entre 1800 et 1850. Ce phénomène n’était pas véritablement une période glaciaire — celle-ci ayant pris fin il y a environ dix mille ans — mais représentait néanmoins le moment le plus froid enregistré au cours des cinq derniers siècles.
Météo Dévastatrice en Europe
D’après Hutchison,il n’existe pas de témoignages écrits directs relatant cette éruption en raison du caractère éloigné et peu habité des îles Kouriles souvent enveloppées par un épais brouillard. Cependant, son impact est bien documenté : le compositeur allemand Felix Mendelssohn évoquait un été « désolé » en traversant les Alpes où les températures étaient « aussi froides qu’en hiver ». De nombreux récits rapportent également que le soleil prenait des teintes bleues ou violettes dues aux particules aérosols émises par le panache du volcan. Un phénomène similaire avait été observé après l’éruption du Krakatoa en 1883.

Dérives Mortelles Potentielles
L’éventuelle conséquence mortelle liée à cette éruption pourrait avoir été significative : une baisse globale des températures aurait précédé plusieurs famines majeures en Inde et au Japon durant les années 1830. Hutchison souligne : « Nous savons qu’avec de grandes éruptions volcaniques comme celle-ci, lorsque vous avez un refroidissement climatique cela entraîne aussi des modifications dans les précipitations ainsi que dans les rendements agricoles. » Cela peut engendrer une pénurie alimentaire pour la population.
Mise en Évidence Scientifique Cruciale
Afin d’identifier précisément la source de cet événement cataclysmique passé, Hutchison et son équipe ont examiné les résidus cendreux présents dans diverses carottes glaciaires datant du XIXe siècle prélevées au Groenland. La composition chimique correspondante aux cendres trouvées indiquait clairement leur origine commune avec celles provenant notamment du Japon voisin; cependant ils ont rapidement exclu ce pays comme site potentiel étant donné sa densité démographique élevée ainsi qu’un historique bien documenté concernant ses propres activités volcaniques.
Cela a conduit leurs recherches vers les îles Kouriles.
Sensation ‘Eureka’
L’équipe scientifique découvrit alors que la composition chimique présente aux dépôts cendreux issus du volcano Zavaritskii correspond parfaitement avec celle retrouvée dans ces carottes glaciaires; Hutchison qualifie cela comme étant un moment ‘Eureka’, semblable à celui où on trouve une empreinte digitale lors d’une enquête criminelle.
« C’était vraiment une journée fantastique, » se remémore-t-il avec enthousiasme; « l’une des meilleures journées passées au laboratoire. »
Alerte Manquante Sur Les Volcans Actuels
Tandis qu’ils avaient résolu ce mystère historique lié à l’éruption de 1831 , Hutchison note cependant qu’il n’existe toujours aucun système instrumentalisé surveillant activement toute activité potentielle autour des volcans situés aux îles Kouriles — situation valable pour bon nombre autres volcans autour globe.
« Si cette même éruption devait se produire aujourd’hui, » conclut-il prudemment ; « je ne pense pas que nous serions beaucoup mieux préparés comparativement à notre situation durant année 1831. » Cela illustre combien il sera difficile prédire quand ou où pourrait surgir prochainement un autre événement majeur susceptible modifier notre climat. »
Science et nature
La « reine des loups » de Yellowstone tuée par une meute rivale après 11 ans de vie et 10 portées de louveteaux
Le parc national de Yellowstone a perdu l’une de ses habitantes les plus emblématiques : Wolf 907F, surnommée la « Reine des Loups ». À 11 ans, cette louve au regard unique avait déjà donné naissance à un incroyable nombre de 10 portées. Sa longévité exceptionnelle et son rôle de matriarche en faisaient une figure légendaire. Malheureusement, après une confrontation avec un groupe rival le jour de Noël, sa vie s’est éteinte. Malgré les défis qu’elle a affrontés, Wolf 907F a su mener sa meute avec force et détermination jusqu’à la fin.

Le parc national de Yellowstone a perdu l’un de ses habitants les plus emblématiques et résilients : une louve d’un œil, âgée de 11 ans, qui avait réalisé un exploit en donnant naissance à 10 portées au cours de sa longue vie.
Connue sous le nom affectueux de « Reine des Loups » pour son rôle prépondérant au sein du groupe Junction Butte, la louve 907F est décédée le jour de Noël (25 décembre 2024) suite à une confrontation avec un autre groupe rival.
La louve 907F a vécu plus du double de l’espérance de vie habituelle des loups gris dans le parc, qui est généralement comprise entre quatre et cinq ans. Sa longévité et son statut de matriarche en ont fait une figure légendaire dans l’écosystème du parc ainsi qu’auprès des passionnés d’animaux sauvages.
les événements ayant conduit à sa mort ont débuté le 22 décembre, lorsque la louve 907F et ses petits se nourrissaient d’une carcasse de bison sur la rive nord du fleuve Yellowstone, d’après Cowboy State Daily.Des membres du groupe rival Rescue Creek — habituellement confinés sur la rive sud — ont traversé le fleuve sans prévenir et se sont engagés dans une violente altercation avec le groupe dirigé par 907F.
Bien que la louve ait survécu à cette première rencontre, ses blessures se sont révélées fatales. Son collier radio, surveillé par les biologistes du parc Yellowstone, a signalé son immobilité le 26 décembre, indiquant qu’elle était probablement décédée la veille.
Une des plus anciennes louves de Yellowstone

Avec ses onze années passées dans ce milieu sauvage depuis leur réintroduction en 1995 au parc national yellowstone,d’après Smithsonian Magazine, elle faisait partie des six rares spécimens ayant atteint cet âge avancé.
Louve courageuse face aux défis rencontrés tout au long de sa vie. Les scientifiques pensent qu’elle aurait perdu son œil gauche vers l’âge four; cependant, les raisons exactes demeurent floues. de plus, elle avait survécu à un épisode sévère dû à la gale — maladie cutanée contagieuse causée par des acariens microscopiques pouvant être mortels.

Même face aux adversités rencontrées tout au long des années passées en tant que leader efficace pour son groupe familial , elle a réussi à donner naissance encore une fois lors du printemps dernier (2024), surprenant ainsi les chercheurs par sa vitalité malgré son âge avancé.
Ayant mis bas chaque année durant toute une décennie avant sa mort dès qu’elle atteignit maturité sexuelle , Rabe affirmait auprès du Cowboy State Daily que cela faisait d’elle « la femelle ayant connu le succès reproductif sans précédent dans toute l’histoire connue ».
Science et nature
Les meilleures offres du MacBook Pro ce mois-ci !
Apple a récemment dévoilé ses nouveaux modèles de MacBook Pro de 14 et 16 pouces, équipés des puissants processeurs M4, M4 Pro et M4 Max. Ces modèles améliorés, lancés en novembre 2024, offrent le double de RAM par rapport à leurs prédécesseurs. Si vous envisagez d’acheter un MacBook Pro, sachez que les anciens modèles M3 sont désormais en liquidation avec des remises intéressantes. Cependant, attention à la différence de RAM ! Découvrez nos conseils pour dénicher les meilleures offres et faire le choix parfait pour vos besoins.

Les Nouveaux Modèles de MacBook Pro : Ce Qu’il Faut Savoir
En octobre 2024, Apple a dévoilé ses derniers modèles de MacBook Pro de 14 et 16 pouces, équipés des puces M4, M4 Pro et M4 Max. Ces nouvelles versions arrivent un an après le lancement des variantes M3, qui avaient déjà fait sensation. Les nouveaux modèles offrent une double capacité de RAM par rapport à leurs prédécesseurs.
Les ventes ont débuté le vendredi 8 novembre et les appareils sont désormais disponibles à l’achat.
Acheter un MacBook Pro : Faut-il opter pour les anciens modèles ?
Si vous envisagez d’acheter un MacBook Pro, vous pourriez être tenté par les modèles de la série M3 qui pourraient bénéficier de réductions alors que les revendeurs écoulent leur stock.Cependant, gardez à l’esprit que ces anciens modèles disposent d’une moitié moins de RAM que les nouveaux. Apple facture environ 200 $/200 £ pour une mise à niveau de la RAM au moment de l’achat ; il est donc essentiel que toute réduction sur un ancien modèle prenne cela en compte. De plus, si vous êtes en dehors des États-Unis, notez que le prix des nouveaux modèles peut être inférieur à celui des anciens.
avec une combinaison d’augmentations et diminutions tarifaires dans toute la gamme par rapport aux générations précédentes, il peut s’avérer difficile d’identifier une bonne affaire. Heureusement, notre équipe d’experts apple scrute Internet tout au long de l’année pour dénicher les meilleures offres sur le MacBook pro ainsi que sur le MacBook Air qui présente également plusieurs similitudes avec son homologue pro.
Comparaison des Prix Actuels
Vous trouverez ci-dessous des tableaux comparatifs affichant les meilleurs prix actuels pour chaque modèle standard du MacBook Pro (y compris ceux mis en vente depuis le 8 novembre). Des offres sont également disponibles pour certains modèles désormais discontinués tant qu’ils restent en stock chez divers détaillants.
Aperçu des Meilleures Offres Actuelles
- M4 – MacBook Pro 14 pouces :
- Amazone : modèle avec 512 Go/16 Go RAM – $1,459 (140 $ off)
- Amazone : Modèle avec 1 To/24 Go RAM – $1,819 (180 $ off)
- Amazone : Modèle M4 Pro avec 1 To/24 Go RAM – $2,179 (220 $ off)
- Amazone : Modèle M4 Max avec 16 pouces – À partir de $3,174 (325 $ off)
Détails Sur Les Offres Discontinuées
- M3 – ancien modèle :
- B&H photo: Modèle avec 512 Go/18 Go RAM – Environ $1,599 (-400$)
- Best Buy: Version précédente du modèle pro – Environ $2,199 (-300$)
L’Importance D’un Guide D’Achat Complet
Pour obtenir davantage d’informations et choisir votre ordinateur portable Apple idéalement adapté à vos besoins spécifiques ou professionnels , consultez notre guide complet où nous abordons tous les différents types disponibles ainsi qu’un guide spécifique aux achats concernant toute la gamme Macintosh.
Démarche Pour Acquérir Un Nouveau Produit Apple
Tandis qu’il est possible d’acquérir directement auprès d’Apple ou via divers revendeurs agréés dans le monde entier — beaucoup offrant aussi bien sur produits neufs qu’anciens — il vaut toujours mieux comparer avant achat afin maximiser vos économies potentielles ! Vous pouvez consulter nos recommandations concernant où acheter votre prochain appareil Macintosh ici même !
Détaillants Recommandés Aux États-Unis :
- Boutique officielle Apple
- Boutique Éducation Apple
- Amazone
< li>B&H Photo < li > Best Buy < / li >< li > Walmart < / li >< / ul >
< h r >
< h r >
< p > Si vous recherchez encore plus moyen économe , découvrez si acheter vos produits électroniques depuis un autre pays pourrait réduire considérablement votre budget .< / p >
< h r >
< h r >
< h o u t e s t i n g = "u k retailers" >Détaillants Recommandés Au Royaume-Uni:
< ul >< li > Boutique officielle Apple< / li >< li > Boutique Éducation Apple< / li >< li > Amazone< / li >< < ...
-

 Business1 an ago
Business1 an agoComment lutter efficacement contre le financement du terrorisme au Nigeria : le point de vue du directeur de la NFIU
-
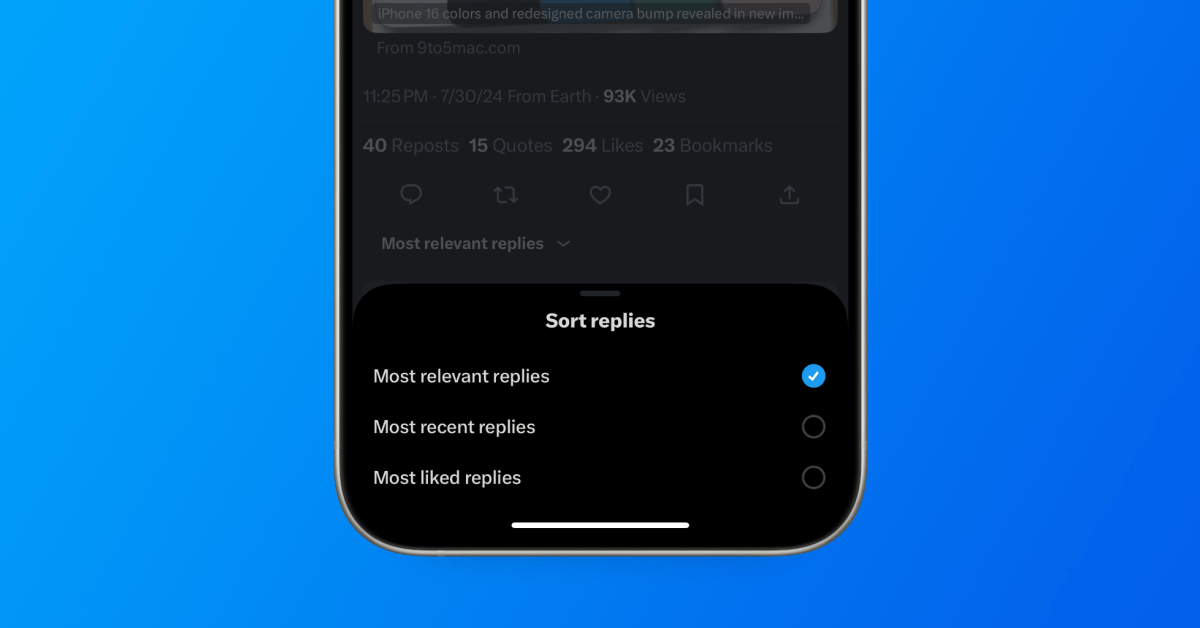
 Général2 ans ago
Général2 ans agoX (anciennement Twitter) permet enfin de trier les réponses sur iPhone !
-

 Technologie1 an ago
Technologie1 an agoTikTok revient en force aux États-Unis, mais pas sur l’App Store !
-

 Général1 an ago
Général1 an agoAnker SOLIX dévoile la Solarbank 2 AC : la nouvelle ère du stockage d’énergie ultra-compatible !
-

 Général1 an ago
Général1 an agoLa Gazelle de Val (405) : La Star Incontournable du Quinté d’Aujourd’hui !
-

 Sport1 an ago
Sport1 an agoSaisissez les opportunités en or ce lundi 20 janvier 2025 !
-

 Business1 an ago
Business1 an agoUne formidable nouvelle pour les conducteurs de voitures électriques !
-

 Science et nature1 an ago
Science et nature1 an agoLes meilleures offres du MacBook Pro ce mois-ci !