Général
Une Nouvelle Révolution de l’IA dans la Conception des Protéines !
Des chercheurs de l’EPFL ont développé CARBonAra, un modèle innovant basé sur l’IA capable de prédire les séquences protéiques à partir de structures de base, tout en tenant compte des environnements moléculaires complexes. Cette avancée promet de révolutionner l’ingénierie des protéines, avec des applications potentielles en médecine et en biotechnologie. En intégrant des contextes moléculaires variés, CARBonAra améliore considérablement les taux de récupération des séquences, ouvrant ainsi la voie à des traitements ciblés et à des enzymes sur mesure pour l’industrie.
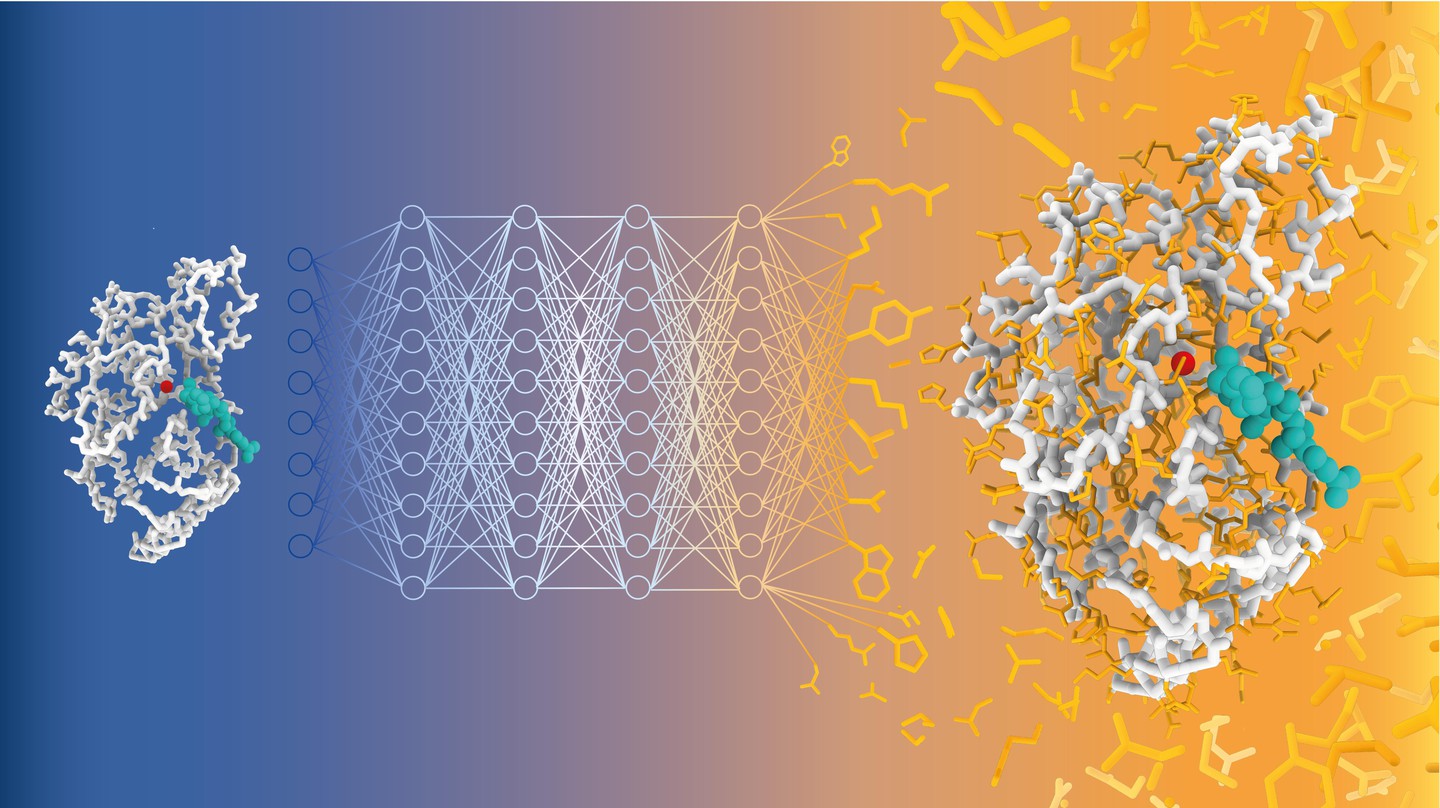
Une avancée révolutionnaire dans l’ingénierie des protéines grâce à l’IA
Des chercheurs de l’EPFL ont mis au point un modèle innovant basé sur l’intelligence artificielle, capable de prédire les séquences de protéines à partir de structures de base, tout en tenant compte des environnements moléculaires complexes. Cette avancée promet d’importants progrès dans le domaine de l’ingénierie des protéines, avec des applications potentielles dans divers secteurs, notamment la médecine et la biotechnologie.
La conception de protéines : un défi majeur
La création de protéines capables d’exécuter des fonctions spécifiques nécessite une compréhension approfondie de leurs séquences et structures. Ce processus est essentiel pour le développement de traitements ciblés contre les maladies et pour la création d’enzymes destinées à des applications industrielles.
L’un des défis majeurs en ingénierie des protéines est la conception de protéines de novo, c’est-à-dire à partir de zéro, afin d’adapter leurs propriétés à des tâches spécifiques. Cela a des implications profondes pour la biologie, la médecine et la science des matériaux. Par exemple, les protéines conçues peuvent cibler des maladies avec une grande précision, offrant une alternative compétitive aux médicaments traditionnels à base de petites molécules.
Les enzymes sur mesure : catalyseurs naturels
Les enzymes conçues sur mesure, qui agissent comme des catalyseurs naturels, peuvent faciliter des réactions rares ou inexistantes dans la nature. Cette capacité est particulièrement précieuse dans l’industrie pharmaceutique pour la synthèse de molécules médicamenteuses complexes, ainsi que dans la technologie environnementale pour décomposer plus efficacement les polluants ou les plastiques.
CARBonAra : un modèle d’IA innovant
Une équipe de scientifiques dirigée par Matteo Dal Peraro à l’EPFL a développé CARBonAra (Récupération d’acides aminés contextuels à partir d’atomes de base et d’hétéroatomes), un modèle d’IA capable de prédire des séquences de protéines tout en prenant en compte les contraintes imposées par différents environnements moléculaires. CARBonAra a été formé sur un ensemble de données d’environ 370 000 sous-unités, avec 100 000 supplémentaires pour la validation et 70 000 pour les tests, provenant de la Banque de données des protéines (PDB).
CARBonAra s’appuie sur l’architecture du cadre de transformation de structure protéique (PeSTo), également développé par Lucien Krapp dans le groupe de Dal Peraro. Il utilise des transformateurs géométriques, qui sont des modèles d’apprentissage profond traitant les relations spatiales entre les points, comme les coordonnées atomiques, pour apprendre et prédire des structures complexes.
Amélioration des taux de récupération des séquences
CARBonAra est capable de prédire des séquences d’acides aminés à partir de structures de base, qui constituent les cadres structurels des molécules protéiques. L’une des caractéristiques remarquables de CARBonAra est sa conscience contextuelle, qui se manifeste particulièrement dans l’amélioration des taux de récupération des séquences – le pourcentage d’acides aminés corrects prédits à chaque position d’une séquence protéique par rapport à une séquence de référence connue.
Les taux de récupération se sont considérablement améliorés lorsque le modèle intègre des « contextes » moléculaires, tels que les interfaces protéiques avec d’autres protéines, des acides nucléiques, des lipides ou des ions. « Cela est dû au fait que le modèle est formé avec toutes sortes de molécules et repose uniquement sur des coordonnées atomiques, ce qui lui permet de traiter non seulement des protéines », explique Dal Peraro. Cette caractéristique renforce le pouvoir prédictif du modèle et son applicabilité dans des systèmes biologiques complexes et réels.
Validation expérimentale et applications industrielles
Le modèle ne se limite pas à des benchmarks synthétiques, mais a également été validé expérimentalement. Les chercheurs ont utilisé CARBonAra pour concevoir de nouvelles variantes de l’enzyme TEM-1 β-lactamase, impliquée dans le développement de la résistance aux antimicrobiens. Certaines des séquences prédites, présentant environ 50 % de différences par rapport à la séquence sauvage, ont été correctement repliées et conservent une certaine activité catalytique à des températures élevées, alors que l’enzyme sauvage est déjà inactive.
La flexibilité et la précision de CARBonAra ouvrent de nouvelles perspectives pour l’ingénierie des protéines. Sa capacité à prendre en compte des environnements moléculaires complexes en fait un outil précieux pour concevoir des protéines avec des fonctions spécifiques, renforçant ainsi les futures campagnes de découverte de médicaments. De plus, le succès de CARBonAra dans l’ingénierie des enzymes démontre son potentiel pour des applications industrielles et des recherches scientifiques.
Général
Anker SOLIX dévoile la Solarbank 2 AC : la nouvelle ère du stockage d’énergie ultra-compatible !
Découvrez le Solarbank 2 AC, une véritable révolution dans le domaine de l’énergie solaire ! Grâce à ses batteries au phosphate de fer lithium, ce système s’adapte parfaitement à vos besoins. Avec une puissance impressionnante de 2400 watts et la possibilité d’ajouter jusqu’à cinq batteries supplémentaires, il assure un stockage optimal. Sa compatibilité avec le compteur Anker SOLIX Smart favorise une gestion intelligente de votre consommation énergétique. Ne ratez pas l’offre spéciale « early bird », disponible dès maintenant pour seulement 999 euros ! Saisissez cette chance unique !

Le Solarbank 2 AC : Une Révolution dans le Stockage Énergétique
Batteries au Lithium Fer Phosphate
Le Solarbank 2 AC se démarque par l’utilisation de batteries au lithium fer phosphate (LFP), reconnues pour leur sécurité et leur efficacité. Ce modèle est particulièrement innovant grâce à son système de couplage alternatif, qui lui permet de s’adapter facilement à divers systèmes solaires déjà en place.Que ce soit pour des installations sur toiture, des systèmes solaires compacts pour balcons ou d’autres configurations réduites, il peut fonctionner avec un micro-onduleur de 800 Watts.
Capacité et flexibilité Énergétique
Avec une capacité maximale d’injection dans le réseau domestique atteignant 1200 watts,le Solarbank 2 AC peut être associé à deux régulateurs solaires MPPT. Cela ouvre la possibilité d’ajouter jusqu’à 1200 watts supplémentaires via des panneaux solaires additionnels, portant ainsi la puissance totale à un impressionnant 2400 watts. Pour les utilisateurs nécessitant davantage de stockage énergétique, il est possible d’intégrer jusqu’à cinq batteries supplémentaires de 1,6 kilowattheure chacune, augmentant la capacité totale à 9,6 kilowattheures.
Intégration dans un Écosystème Intelligent
Le Solarbank 2 AC s’intègre parfaitement dans un écosystème énergétique intelligent grâce à sa compatibilité avec le compteur Anker SOLIX Smart et les prises intelligentes proposées par Anker. cette fonctionnalité permet une gestion optimisée de la consommation électrique tout en réduisant les pertes énergétiques inutiles. De plus, Anker SOLIX prévoit d’étendre cette compatibilité aux dispositifs Shelly.
Durabilité et Résistance aux Intempéries
Anker SOLIX met également l’accent sur la longévité du Solarbank 2 AC. Conçu pour supporter au moins 6000 cycles de charge, cet appareil a une durée de vie estimée dépassant quinze ans. Il est accompagné d’une garantie fabricant décennale et possède une certification IP65 qui assure sa résistance face aux intempéries tout en étant capable de fonctionner dans des températures variant entre -20 °C et +55 °C.
Disponibilité et Offres Promotionnelles
Le solarbank 2 AC est disponible sur le site officiel d’Anker SOLIX ainsi que sur Amazon au prix standard de 1299 euros. Cependant, une offre promotionnelle « early bird » sera active du 20 janvier au 23 février 2025, permettant aux acheteurs intéressés d’acquérir cet appareil dès 999 euros ! Cette promotion inclut également un compteur Anker SOLIX Smart offert pour chaque commande passée durant cette période spéciale.
le Solarbank 2 AC représente une avancée significative dans le domaine du stockage énergétique domestique grâce à ses caractéristiques techniques avancées et son engagement envers la durabilité environnementale.
Business
Une formidable nouvelle pour les conducteurs de voitures électriques !
Excellente nouvelle pour les conducteurs de véhicules électriques ! La recharge gratuite sur le lieu de travail sera exonérée d’impôts jusqu’en 2025. Annoncée par le ministère de l’Économie, cette mesure incitative, en place depuis 2020, s’inscrit dans une dynamique de croissance impressionnante avec une progression annuelle moyenne de 35%. Les entreprises peuvent ainsi offrir des bornes de recharge sans impact fiscal, stimulant la transition écologique. Reste à savoir si cela suffira à convaincre les entreprises hésitantes et à propulser l’électrification des flottes professionnelles vers un avenir durable.

Technologie
Recharge Électrique au Bureau : Une Exonération Fiscale Renouvelée
Les détenteurs de véhicules électriques et leurs employeurs peuvent se réjouir : la possibilité d’effectuer des recharges gratuites sur le lieu de travail sera exonérée d’impôts jusqu’en 2025. Cette décision, annoncée par le ministère des Finances, prolonge une initiative lancée en 2020 pour encourager l’adoption des véhicules électriques dans les entreprises.
Un Secteur en Croissance Dynamique
Cette prolongation intervient à un moment clé, alors que le marché des voitures électriques continue d’afficher une croissance remarquable. Entre 2020 et 2022, la progression annuelle moyenne a atteint 35%. En 2023, les particuliers représentent désormais 84% des acquisitions de véhicules électriques, contre seulement 68% en 2018.
Concrètement,cette mesure permet aux sociétés d’installer gratuitement des bornes de recharge pour leurs employés sans impact fiscal. Les frais liés à l’électricité pour ces recharges ne seront pas pris en compte dans le calcul des avantages en nature. De plus, un abattement de 50% sur ces avantages est maintenu avec un plafond révisé à environ 2000 euros pour l’année prochaine.
Accélération Vers une Mobilité Électrique
Cette initiative fait partie d’une stratégie globale visant à promouvoir l’électrification du parc automobile français. Cependant, les grandes entreprises rencontrent encore des difficultés pour atteindre leurs objectifs ; seulement 8% des nouveaux véhicules immatriculés par ces entités étaient électriques en 2023. Ces incitations fiscales pourraient néanmoins inciter davantage d’employeurs à franchir le pas.Cependant, plusieurs défis demeurent concernant les infrastructures nécessaires au chargement ainsi que sur l’autonomie des véhicules et les perceptions parmi les employés. Par ailleurs, la réduction progressive du bonus écologique pour les utilitaires et sa diminution pour les particuliers pourraient freiner cet élan vers une adoption plus large.
Avenir Prometteur Pour La Mobilité Électrique
Malgré ces obstacles potentiels, il existe un optimisme quant au futur de la mobilité électrique dans le milieu professionnel. Les avancées technologiques continues ainsi qu’un engagement croissant envers la durabilité devraient continuer à favoriser cette tendance vers une adoption accrue des véhicules écologiques.
En maintenant ces mesures fiscales avantageuses jusqu’en 2025 et au-delà, le gouvernement délivre un message fort soutenant la transition écologique dans le secteur du transport. Reste maintenant à voir si cela suffira réellement à convaincre certaines entreprises hésitantes et si cela permettra d’accélérer significativement l’électrification de leurs flottes professionnelles dans un avenir proche.
Divertissement
« À la rencontre d’un Hugo : une aventure inattendue »
Le prénom, un véritable reflet de notre identité, peut être à la fois lourd à porter et source de fierté. Dans cette chronique fascinante, le réalisateur Hugo David nous plonge dans son expérience avec un prénom très répandu. Né en 2000, il se retrouve entouré d’autres Hugo, ce qui l’amène à adopter un alias : Hugo D.. Comment ce choix a-t-il influencé son parcours ? Explorez les nuances et les histoires derrière nos prénoms et découvrez comment ils façonnent nos vies dès l’enfance jusqu’à l’âge adulte !

Les Prénoms : Un Voyage au Cœur de l’Identité
Le Rôle Crucial des Prénoms dans nos Existences
Chaque personne possède un prénom, qu’il soit courant ou singulier, et ce dernier peut engendrer à la fois fierté et embarras. Cet article explore la signification profonde et l’influence des prénoms sur notre vie quotidienne. Le réalisateur Hugo David partage son vécu avec un prénom qui a connu une forte popularité durant sa jeunesse.
une Naissance Sous le Signe de la Célébrité
Hugo David est né en 2000 à Tours, une époque où le prénom Hugo était en plein essor. Ses parents, Caroline et Rodolphe, avaient envisagé d’autres choix comme Enzo, également très en vogue à cette période. « Je pense que mes parents ont opté pour un prénom parmi les plus répandus en France plutôt qu’en hommage à Victor Hugo », confie-t-il.
Une Enfance Entourée d’Autres « Hugo »
Dès son plus jeune âge, Hugo se retrouve entouré d’autres enfants portant le même nom. Selon les statistiques de l’Insee,7 694 garçons ont été prénommés Hugo en 2000,faisant de ce prénom le quatrième plus populaire cette année-là. À l’école primaire,il côtoie plusieurs camarades appelés Thibault et autres prénoms similaires. Pour éviter toute confusion lors des appels en classe, les enseignants ajoutent souvent la première lettre du nom de famille après le prénom : ainsi devient-il rapidement « Hugo D. », un surnom auquel il s’habitue sans arduousé.
Pensées sur l’Identité Associée au Prénom
Le choix d’un prénom peut avoir un impact significatif sur notre identité personnelle tout au long de notre existence. Que ce soit pour se distinguer ou pour s’intégrer dans un groupe social spécifique, chaque individu développe une relation particulière avec son propre nom.
les prénoms ne sont pas simplement des désignations ; ils portent avec eux des récits et influencent nos interactions sociales depuis notre enfance jusqu’à l’âge adulte.
-

 Business1 an ago
Business1 an agoComment lutter efficacement contre le financement du terrorisme au Nigeria : le point de vue du directeur de la NFIU
-
 Général2 ans ago
Général2 ans agoX (anciennement Twitter) permet enfin de trier les réponses sur iPhone !
-

 Technologie1 an ago
Technologie1 an agoTikTok revient en force aux États-Unis, mais pas sur l’App Store !
-

 Général1 an ago
Général1 an agoAnker SOLIX dévoile la Solarbank 2 AC : la nouvelle ère du stockage d’énergie ultra-compatible !
-

 Général1 an ago
Général1 an agoLa Gazelle de Val (405) : La Star Incontournable du Quinté d’Aujourd’hui !
-

 Sport1 an ago
Sport1 an agoSaisissez les opportunités en or ce lundi 20 janvier 2025 !
-

 Business1 an ago
Business1 an agoUne formidable nouvelle pour les conducteurs de voitures électriques !
-

 Science et nature1 an ago
Science et nature1 an agoLes meilleures offres du MacBook Pro ce mois-ci !