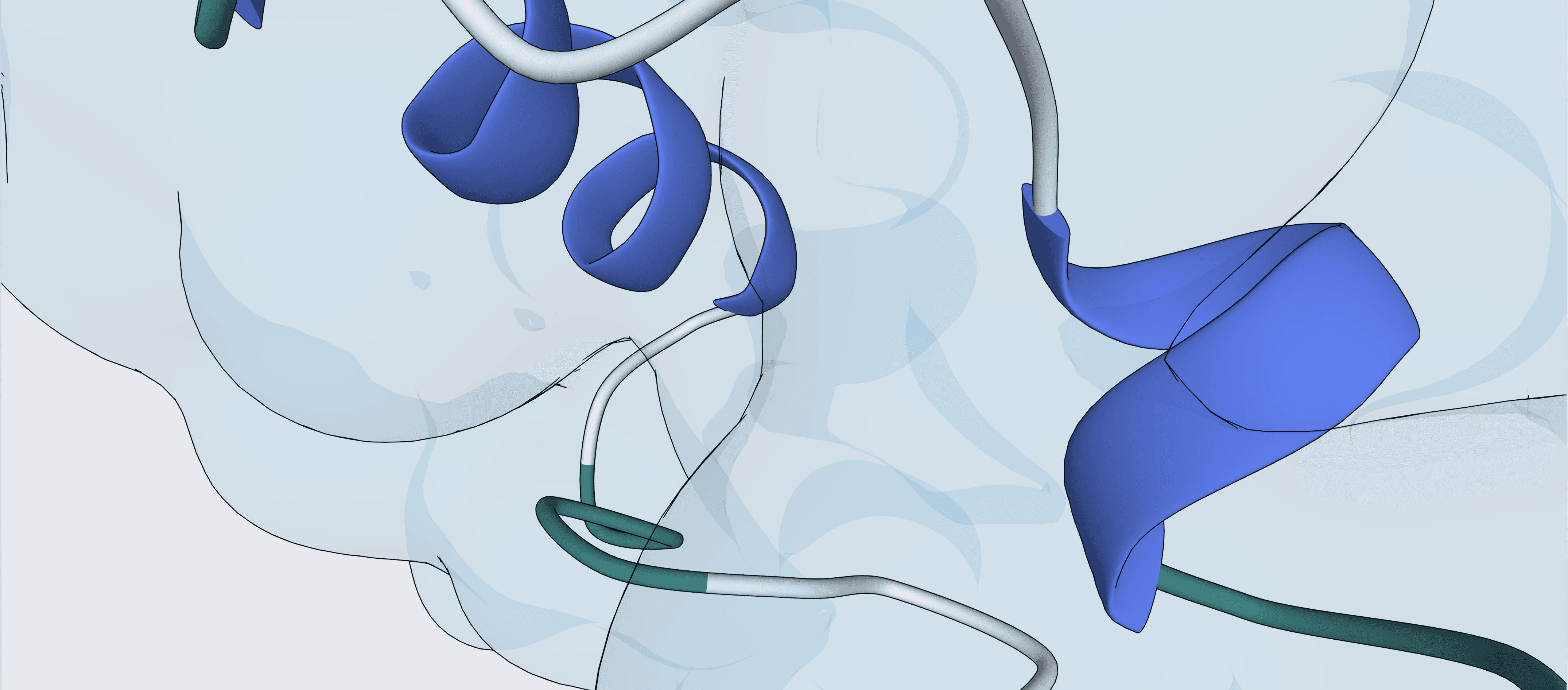Une Nouvelle Approche pour Traiter les Infections Urinaires
Des recherches récentes indiquent que des virus utilisant l’outil d’édition génétique CRISPR pourraient un jour offrir une solution pour traiter les infections urinaires (IU). Les résultats d’un essai clinique préliminaire montrent un potentiel prometteur, bien que cette thérapie expérimentale doive encore passer par plusieurs phases de tests avant d’être approuvée pour un usage clinique.
Les Phages : Une Alternative aux Antibiotiques Traditionnels
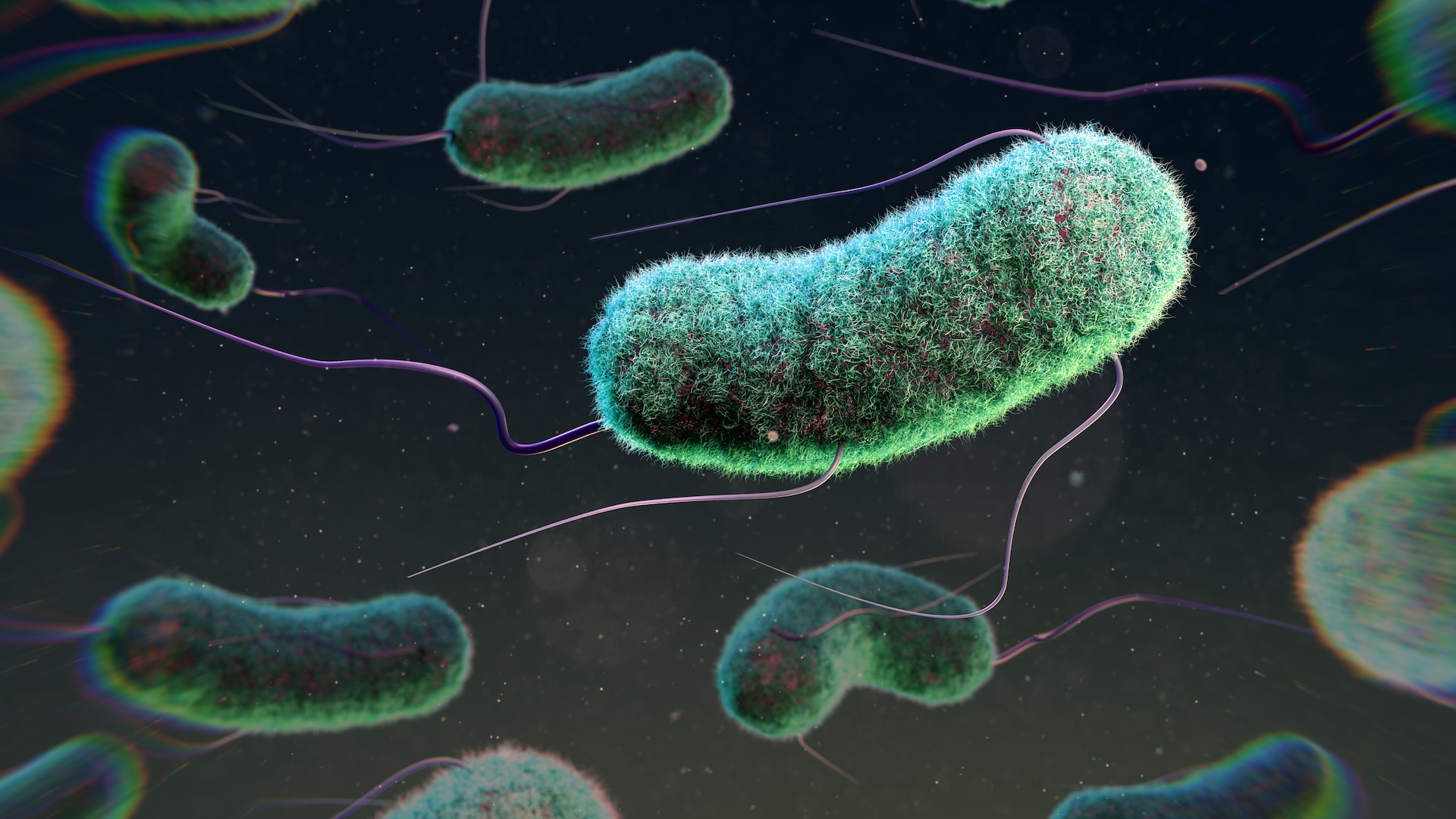
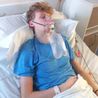
Cette nouvelle méthode exploite les bactériophages, des virus qui ciblent spécifiquement les bactéries. Ces phages, comme on les appelle souvent, sont en cours de développement comme une alternative potentielle aux antibiotiques classiques. Leur attrait réside dans leur capacité à cibler des souches bactériennes spécifiques, évitant ainsi les problèmes liés aux antibiotiques à large spectre qui peuvent détruire une variété de bactéries, entraînant une pression évolutive sur les microbes pour développer une résistance.
Les antibiotiques à large spectre peuvent également nuire aux bactéries bénéfiques, notamment celles présentes dans le microbiome intestinal. Bien que les phages ne soient pas totalement à l’abri de la résistance, il est possible de combiner plusieurs phages dans un même traitement, ce qui complique la tâche des bactéries pour échapper à leur action.
Focus sur LBP-EC01
Le traitement LBP-EC01, en cours d’évaluation pour les IU, est spécifiquement conçu pour cibler Escherichia coli, le principal responsable de ces infections. Développé par Locus Biosciences, ce traitement a été décrit dans une étude publiée le 9 août dans la revue The Lancet Infectious Diseases. LBP-EC01 est destiné à être utilisé en complément d’un antibiotique traditionnel, augmentant ainsi son efficacité et réduisant la dose nécessaire pour éradiquer l’infection.
Ce traitement contient six phages, dont trois sont « lytiques », c’est-à-dire qu’ils pénètrent dans les cellules bactériennes et les détruisent. Les trois autres phages sont modifiés pour transporter des gènes d’un système CRISPR, un outil précis capable de cibler des séquences spécifiques de l’ADN. Une fois à l’intérieur d’une cellule E. coli, ce système CRISPR attaque des segments du génome bactérien essentiels à la survie de la bactérie.
Résultats Prometteurs des Essais Cliniques
Locus Biosciences a récemment terminé la première phase d’un essai clinique en deux parties pour LBP-EC01, ciblant les IU non compliquées, c’est-à-dire celles qui ne sont pas associées à des anomalies structurelles du tractus urinaire ou à d’autres problèmes médicaux, comme un système immunitaire affaibli.
Cette première phase a impliqué 39 patientes adultes, avec pour objectif de déterminer une dose sûre pour les tests ultérieurs. Toutes les participantes avaient un antécédent d’au moins une IU résistante aux médicaments causée par E. coli dans l’année précédant l’essai.
Les résultats ont révélé qu’un traitement rapide de trois jours, administré avec un antibiotique appelé triméthoprime-sulfaméthoxazole (nom commercial Bactrim), n’a entraîné aucun effet secondaire grave. De plus, les échantillons de bactéries des patientes n’ont montré aucun signe de résistance après le traitement.
Une Efficacité Observée
Dans un sous-groupe de 16 patientes, les chercheurs ont observé une « réduction rapide de E. coli » dans les urines dans les quatre heures suivant la première dose. Tous les symptômes d’IU avaient disparu chez ces patientes d’ici le dixième jour après le début du traitement. À ce moment-là, 14 des 16 patientes avaient des niveaux d’E. coli suffisamment bas pour être considérées comme guéries.
Il est à noter que 11 de ces 16 patientes étaient infectées par des bactéries résistantes au TMP-SMX au départ, ce qui suggère que le traitement par phages a agi en synergie avec l’antibiotique, abaissant les défenses des bactéries pour permettre l’élimination même des infections résistantes.
Perspectives d’Avenir
Bien que l’objectif principal de cette étude ait été de déterminer une dose, la seconde phase de l’essai comparera maintenant LBP-EC01 à un placebo. De plus, la première phase de l’essai était relativement petite, mais la prochaine phase pourrait inclure jusqu’à 288 participants.
Il reste encore du travail à accomplir pour obtenir l’approbation officielle de LBP-EC01. Cependant, de manière générale, « je peux envisager que ce type de traitement soit disponible dans un délai de cinq à dix ans », a déclaré Beisel.