Général
Efanesoctocog Alfa : Une Révolution dans la Prévention des Hémorragies chez les Enfants Atteints d’Hémophilie A Sévère !
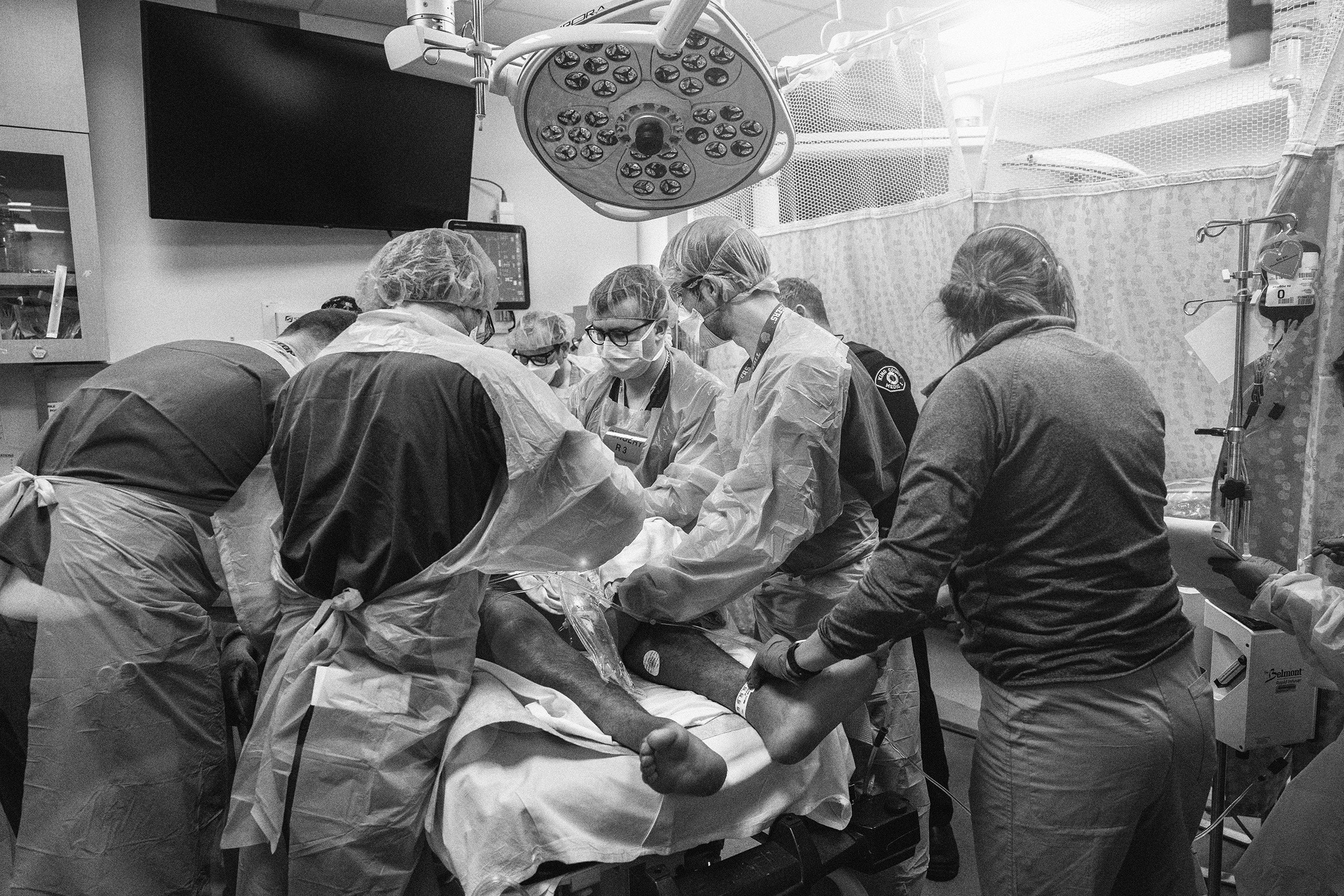
Une avancée majeure pour les enfants atteints d’hémophilie A sévère ! Le traitement prophylactique hebdomadaire avec efanesoctocog alfa (Altuviiio) a montré une efficacité remarquable dans la prévention des saignements, selon l’étude XTEND-Kids. Aucun des 74 garçons participants n’a développé d’inhibiteurs du facteur VIII. Avec un taux de saignement annualisé médian de 0,00, ce traitement pourrait transformer la qualité de vie des jeunes patients. La prévention précoce des saignements dans les articulations est essentielle pour préserver leur santé à long terme. Une lueur d’espoir pour les familles touchées par cette maladie !
—
Aucun inhibiteur du facteur VIII développé chez les 74 garçons inclus dans l’étude
Le traitement prophylactique hebdomadaire avec l’efanesoctocog alfa (Altuviiio) a montré une activité élevée et durable du facteur VIII, s’avérant efficace pour prévenir les saignements chez les enfants atteints d’hémophilie A sévère, selon les résultats de l’étude de phase III XTEND-Kids.
Aucun des 74 enfants participants, tous des garçons de moins de 12 ans, n’a développé d’inhibiteurs du facteur VIII (anticorps neutralisants contre le facteur VIII) durant l’étude, a rapporté Lynn Malec, MD, du Versiti Blood Research Institute à Milwaukee, et ses collègues.
Parmi les 73 patients traités conformément au protocole, la thérapie de remplacement du facteur VIII a entraîné un taux médian de saignements annualisés de 0,00 (intervalle interquartile 0,00-1,02) et un taux moyen annualisé basé sur un modèle de 0,61 (IC à 95 % 0,42-0,90), comme indiqué dans le New England Journal of Medicine.
De plus, 64 % des patients n’ont eu aucun épisode de saignement traité, 88 % n’ont pas présenté d’épisodes de saignement spontané, et 82 % n’ont pas eu d’épisodes de saignement dans les articulations.
« L’efanesoctocog alfa a également permis un traitement efficace des épisodes de saignement », ont noté les auteurs, avec 95 % des épisodes résolus par une seule injection.
La protection efficace contre les épisodes de saignement chez les enfants atteints d’hémophilie A sévère « a été difficile à atteindre sans régimes de traitement lourds », ont écrit Malec et ses collègues.
« La prophylaxie primaire est essentielle pour prévenir les saignements dans les articulations et les arthropathies hémophiliques subséquentes, tout en maintenant la santé articulaire tout au long de la vie », ont-ils observé. « Dans notre étude, la prophylaxie avec l’efanesoctocog alfa a entraîné un faible taux annualisé de saignements dans les articulations. Étant donné l’impact que la mauvaise santé articulaire peut avoir sur la qualité de vie, la prévention précoce des saignements dans les articulations pourrait contribuer à améliorer la qualité de vie et à favoriser une plus grande équité en santé dans cette tranche d’âge, surtout sur le long terme. »
En 2023, la FDA a approuvé l’efanesoctocog alfa pour le traitement des adultes et des enfants atteints d’hémophilie A, sur la base des résultats de l’étude de phase III XTEND-1, où le traitement hebdomadaire avec l’efanesoctocog alfa a abouti à un taux médian de saignements annualisés de 0, et a réduit le taux moyen annualisé de saignements de 77 % par rapport à un régime prophylactique standard de facteur VIII. L’approbation a également été fondée sur des données intermédiaires de XTEND-Kids.
Bien que Malec et ses collègues aient averti que les résultats des essais ne peuvent pas être directement comparés en raison de populations de patients et de conceptions d’essai différentes, ils ont noté que les résultats de XTEND-Kids ont montré une « protection favorable contre les saignements » par rapport à d’autres produits de facteur VIII à demi-vie prolongée, tels que le damoctocog alfa pegol évalué dans l’étude PROTECT VIII Kids, le rurioctocog alfa pegol, et l’efmoroctocog alfa évalué dans l’étude Kids A-LONG.
Dans un éditorial accompagnant intitulé « La science derrière l’étude », Pratima Chowdary, MD, de l’Hôpital Royal Free à Londres, a souligné que l’étude présente la limitation d’avoir inclus uniquement des patients ayant déjà été exposés au facteur VIII et sans inhibiteurs, ce qui signifie que seuls des patients avec une tolérance préexistante au facteur VIII ont été inclus dans l’essai.
« Ainsi, l’immunogénicité doit être évaluée chez d’autres patients, en particulier ceux n’ayant jamais été traités avec le facteur VIII », a-t-elle écrit.
Chowdary a également abordé la question de la réalisation d’études pédiatriques dans les maladies rares, notant que cela implique de nombreux défis éthiques et pratiques, ce qui se reflète dans le choix de la sécurité plutôt que de l’efficacité comme critère principal dans cette étude.
« Si l’effet d’un médicament est peu susceptible de varier selon les groupes d’âge (étant donné la connaissance des caractéristiques biologiques de la maladie et des caractéristiques du médicament), un cohort relativement petit de patients peut fournir des informations sur l’influence de l’âge sur la pharmacocinétique », a-t-elle ajouté. « Il y a un intérêt croissant à utiliser des études de surveillance post-commercialisation pour compléter les études pivots impliquant des adultes. Cette approche permet de collecter des données du monde réel sur la sécurité et l’efficacité des médicaments dans les populations pédiatriques, sans restreindre l’accès aux nouveaux traitements pour les enfants. »
XTEND-Kids était une étude internationale ouverte, à groupe unique, impliquant 74 garçons précédemment traités de moins de 12 ans atteints d’hémophilie A sévère. Parmi ces patients, 73 avaient reçu une prophylaxie avant le début de l’étude, la plupart utilisant des produits à demi-vie prolongée. L’âge médian des patients était de 5 ans, 74 % étaient blancs, 11 % étaient asiatiques et 4 % étaient noirs.
Les patients ont été assignés à recevoir des doses prophylactiques hebdomadaires d’efanesoctocog alfa intraveineux (50 UI/kg de poids corporel) pendant 52 semaines, et les épisodes de saignement ont été traités par une dose d’efanesoctocog alfa, avec des doses supplémentaires de 30 ou 50 UI/kg tous les 2 ou 3 jours si l’épisode ne se résolvait pas.
Le nombre médian total de jours d’exposition à l’efanesoctocog alfa était de 53, et 89 % des patients avaient au moins 50 jours d’exposition.
Malec et ses collègues ont également évalué la qualité de vie à l’aide du questionnaire de qualité de vie en hémophilie pour enfants (score total variant de 0 à 100, des scores plus bas indiquant une meilleure qualité de vie), et ont constaté que le changement moyen du score total de la ligne de base à la semaine 52 était de -2,5 chez 14 patients avec des données disponibles, indiquant une tendance vers une amélioration de la qualité de vie.
Général
Anker SOLIX dévoile la Solarbank 2 AC : la nouvelle ère du stockage d’énergie ultra-compatible !
Découvrez le Solarbank 2 AC, une véritable révolution dans le domaine de l’énergie solaire ! Grâce à ses batteries au phosphate de fer lithium, ce système s’adapte parfaitement à vos besoins. Avec une puissance impressionnante de 2400 watts et la possibilité d’ajouter jusqu’à cinq batteries supplémentaires, il assure un stockage optimal. Sa compatibilité avec le compteur Anker SOLIX Smart favorise une gestion intelligente de votre consommation énergétique. Ne ratez pas l’offre spéciale « early bird », disponible dès maintenant pour seulement 999 euros ! Saisissez cette chance unique !

Le Solarbank 2 AC : Une Révolution dans le Stockage Énergétique
Batteries au Lithium Fer Phosphate
Le Solarbank 2 AC se démarque par l’utilisation de batteries au lithium fer phosphate (LFP), reconnues pour leur sécurité et leur efficacité. Ce modèle est particulièrement innovant grâce à son système de couplage alternatif, qui lui permet de s’adapter facilement à divers systèmes solaires déjà en place.Que ce soit pour des installations sur toiture, des systèmes solaires compacts pour balcons ou d’autres configurations réduites, il peut fonctionner avec un micro-onduleur de 800 Watts.
Capacité et flexibilité Énergétique
Avec une capacité maximale d’injection dans le réseau domestique atteignant 1200 watts,le Solarbank 2 AC peut être associé à deux régulateurs solaires MPPT. Cela ouvre la possibilité d’ajouter jusqu’à 1200 watts supplémentaires via des panneaux solaires additionnels, portant ainsi la puissance totale à un impressionnant 2400 watts. Pour les utilisateurs nécessitant davantage de stockage énergétique, il est possible d’intégrer jusqu’à cinq batteries supplémentaires de 1,6 kilowattheure chacune, augmentant la capacité totale à 9,6 kilowattheures.
Intégration dans un Écosystème Intelligent
Le Solarbank 2 AC s’intègre parfaitement dans un écosystème énergétique intelligent grâce à sa compatibilité avec le compteur Anker SOLIX Smart et les prises intelligentes proposées par Anker. cette fonctionnalité permet une gestion optimisée de la consommation électrique tout en réduisant les pertes énergétiques inutiles. De plus, Anker SOLIX prévoit d’étendre cette compatibilité aux dispositifs Shelly.
Durabilité et Résistance aux Intempéries
Anker SOLIX met également l’accent sur la longévité du Solarbank 2 AC. Conçu pour supporter au moins 6000 cycles de charge, cet appareil a une durée de vie estimée dépassant quinze ans. Il est accompagné d’une garantie fabricant décennale et possède une certification IP65 qui assure sa résistance face aux intempéries tout en étant capable de fonctionner dans des températures variant entre -20 °C et +55 °C.
Disponibilité et Offres Promotionnelles
Le solarbank 2 AC est disponible sur le site officiel d’Anker SOLIX ainsi que sur Amazon au prix standard de 1299 euros. Cependant, une offre promotionnelle « early bird » sera active du 20 janvier au 23 février 2025, permettant aux acheteurs intéressés d’acquérir cet appareil dès 999 euros ! Cette promotion inclut également un compteur Anker SOLIX Smart offert pour chaque commande passée durant cette période spéciale.
le Solarbank 2 AC représente une avancée significative dans le domaine du stockage énergétique domestique grâce à ses caractéristiques techniques avancées et son engagement envers la durabilité environnementale.
Business
Une formidable nouvelle pour les conducteurs de voitures électriques !
Excellente nouvelle pour les conducteurs de véhicules électriques ! La recharge gratuite sur le lieu de travail sera exonérée d’impôts jusqu’en 2025. Annoncée par le ministère de l’Économie, cette mesure incitative, en place depuis 2020, s’inscrit dans une dynamique de croissance impressionnante avec une progression annuelle moyenne de 35%. Les entreprises peuvent ainsi offrir des bornes de recharge sans impact fiscal, stimulant la transition écologique. Reste à savoir si cela suffira à convaincre les entreprises hésitantes et à propulser l’électrification des flottes professionnelles vers un avenir durable.

Technologie
Recharge Électrique au Bureau : Une Exonération Fiscale Renouvelée
Les détenteurs de véhicules électriques et leurs employeurs peuvent se réjouir : la possibilité d’effectuer des recharges gratuites sur le lieu de travail sera exonérée d’impôts jusqu’en 2025. Cette décision, annoncée par le ministère des Finances, prolonge une initiative lancée en 2020 pour encourager l’adoption des véhicules électriques dans les entreprises.
Un Secteur en Croissance Dynamique
Cette prolongation intervient à un moment clé, alors que le marché des voitures électriques continue d’afficher une croissance remarquable. Entre 2020 et 2022, la progression annuelle moyenne a atteint 35%. En 2023, les particuliers représentent désormais 84% des acquisitions de véhicules électriques, contre seulement 68% en 2018.
Concrètement,cette mesure permet aux sociétés d’installer gratuitement des bornes de recharge pour leurs employés sans impact fiscal. Les frais liés à l’électricité pour ces recharges ne seront pas pris en compte dans le calcul des avantages en nature. De plus, un abattement de 50% sur ces avantages est maintenu avec un plafond révisé à environ 2000 euros pour l’année prochaine.
Accélération Vers une Mobilité Électrique
Cette initiative fait partie d’une stratégie globale visant à promouvoir l’électrification du parc automobile français. Cependant, les grandes entreprises rencontrent encore des difficultés pour atteindre leurs objectifs ; seulement 8% des nouveaux véhicules immatriculés par ces entités étaient électriques en 2023. Ces incitations fiscales pourraient néanmoins inciter davantage d’employeurs à franchir le pas.Cependant, plusieurs défis demeurent concernant les infrastructures nécessaires au chargement ainsi que sur l’autonomie des véhicules et les perceptions parmi les employés. Par ailleurs, la réduction progressive du bonus écologique pour les utilitaires et sa diminution pour les particuliers pourraient freiner cet élan vers une adoption plus large.
Avenir Prometteur Pour La Mobilité Électrique
Malgré ces obstacles potentiels, il existe un optimisme quant au futur de la mobilité électrique dans le milieu professionnel. Les avancées technologiques continues ainsi qu’un engagement croissant envers la durabilité devraient continuer à favoriser cette tendance vers une adoption accrue des véhicules écologiques.
En maintenant ces mesures fiscales avantageuses jusqu’en 2025 et au-delà, le gouvernement délivre un message fort soutenant la transition écologique dans le secteur du transport. Reste maintenant à voir si cela suffira réellement à convaincre certaines entreprises hésitantes et si cela permettra d’accélérer significativement l’électrification de leurs flottes professionnelles dans un avenir proche.
Divertissement
« À la rencontre d’un Hugo : une aventure inattendue »
Le prénom, un véritable reflet de notre identité, peut être à la fois lourd à porter et source de fierté. Dans cette chronique fascinante, le réalisateur Hugo David nous plonge dans son expérience avec un prénom très répandu. Né en 2000, il se retrouve entouré d’autres Hugo, ce qui l’amène à adopter un alias : Hugo D.. Comment ce choix a-t-il influencé son parcours ? Explorez les nuances et les histoires derrière nos prénoms et découvrez comment ils façonnent nos vies dès l’enfance jusqu’à l’âge adulte !

Les Prénoms : Un Voyage au Cœur de l’Identité
Le Rôle Crucial des Prénoms dans nos Existences
Chaque personne possède un prénom, qu’il soit courant ou singulier, et ce dernier peut engendrer à la fois fierté et embarras. Cet article explore la signification profonde et l’influence des prénoms sur notre vie quotidienne. Le réalisateur Hugo David partage son vécu avec un prénom qui a connu une forte popularité durant sa jeunesse.
une Naissance Sous le Signe de la Célébrité
Hugo David est né en 2000 à Tours, une époque où le prénom Hugo était en plein essor. Ses parents, Caroline et Rodolphe, avaient envisagé d’autres choix comme Enzo, également très en vogue à cette période. « Je pense que mes parents ont opté pour un prénom parmi les plus répandus en France plutôt qu’en hommage à Victor Hugo », confie-t-il.
Une Enfance Entourée d’Autres « Hugo »
Dès son plus jeune âge, Hugo se retrouve entouré d’autres enfants portant le même nom. Selon les statistiques de l’Insee,7 694 garçons ont été prénommés Hugo en 2000,faisant de ce prénom le quatrième plus populaire cette année-là. À l’école primaire,il côtoie plusieurs camarades appelés Thibault et autres prénoms similaires. Pour éviter toute confusion lors des appels en classe, les enseignants ajoutent souvent la première lettre du nom de famille après le prénom : ainsi devient-il rapidement « Hugo D. », un surnom auquel il s’habitue sans arduousé.
Pensées sur l’Identité Associée au Prénom
Le choix d’un prénom peut avoir un impact significatif sur notre identité personnelle tout au long de notre existence. Que ce soit pour se distinguer ou pour s’intégrer dans un groupe social spécifique, chaque individu développe une relation particulière avec son propre nom.
les prénoms ne sont pas simplement des désignations ; ils portent avec eux des récits et influencent nos interactions sociales depuis notre enfance jusqu’à l’âge adulte.
-

 Business1 an ago
Business1 an agoComment lutter efficacement contre le financement du terrorisme au Nigeria : le point de vue du directeur de la NFIU
-
 Général2 ans ago
Général2 ans agoX (anciennement Twitter) permet enfin de trier les réponses sur iPhone !
-

 Technologie1 an ago
Technologie1 an agoTikTok revient en force aux États-Unis, mais pas sur l’App Store !
-

 Général1 an ago
Général1 an agoAnker SOLIX dévoile la Solarbank 2 AC : la nouvelle ère du stockage d’énergie ultra-compatible !
-

 Général1 an ago
Général1 an agoLa Gazelle de Val (405) : La Star Incontournable du Quinté d’Aujourd’hui !
-

 Sport1 an ago
Sport1 an agoSaisissez les opportunités en or ce lundi 20 janvier 2025 !
-

 Business1 an ago
Business1 an agoUne formidable nouvelle pour les conducteurs de voitures électriques !
-

 Science et nature1 an ago
Science et nature1 an agoLes meilleures offres du MacBook Pro ce mois-ci !