Général
Une étude révèle les facteurs de vulnérabilité et de résilience face à Alzheimer dans différentes régions du cerveau
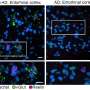
Researchers compared Reelin expression in excitatory neurons in the entorhinal cortex of people with (right) or without (left) Alzheimer’s disease. In people without the disease, vGlut (green), a marker of excitatory neurons, and Reelin (magenta) were often expressed together. In people with Alzheimer’s, excitatory cells exhibited much less Reelin expression. Credit: Tsai Lab/ MIT Picower
Étude sur la vulnérabilité et la résilience face à la maladie d’Alzheimer
Introduction
Une recherche menée par le MIT, récemment publiée dans la revue Nature, apporte de nouvelles perspectives sur la manière dont certaines cellules et circuits cérébraux deviennent sensibles à la maladie d’Alzheimer. Cette étude met également en lumière des facteurs qui pourraient expliquer pourquoi certaines personnes parviennent à maintenir leurs capacités cognitives malgré des signes évidents de pathologie.
Objectifs de l’étude
Les chercheurs ont entrepris une comparaison innovante de l’expression génétique à travers plusieurs régions du cerveau chez des individus atteints ou non de la maladie d’Alzheimer. Ils ont également réalisé des expériences en laboratoire pour tester et valider leurs principales découvertes, dans le but d’identifier des cibles potentielles pour des interventions visant à préserver la cognition et la mémoire.
Méthodologie
Bien que toutes les cellules cérébrales partagent le même ADN, leurs différences d’identité et d’activité proviennent des variations dans l’expression de ces gènes. L’analyse récente a mesuré les différences d’expression génétique dans plus de 1,3 million de cellules, représentant plus de 70 types cellulaires dans six régions cérébrales, à partir de tissus de 48 donneurs. Parmi eux, 26 avaient reçu un diagnostic d’Alzheimer, tandis que 22 n’en souffraient pas.
Cette étude offre un aperçu détaillé et étendu des variations d’activité cellulaire en lien avec la maladie d’Alzheimer, en tenant compte du type de cellule, de la région cérébrale, de la pathologie et de l’évaluation cognitive de chaque individu.
Vulnérabilité des régions cérébrales
« Certaines régions spécifiques du cerveau sont particulièrement vulnérables à la maladie d’Alzheimer, et il est crucial de comprendre comment ces zones ou types cellulaires sont affectés », a déclaré Li-Huei Tsai, co-auteur principal et professeur de neurosciences au MIT. Elle a ajouté que le cerveau ne se compose pas uniquement de neurones, mais aussi de nombreux autres types cellulaires, dont les réponses peuvent varier en fonction de leur localisation.
Avancées technologiques
Manolis Kellis, co-auteur principal et professeur d’informatique, a comparé la technique utilisée pour mesurer l’expression génétique, le profilage d’ARN à cellule unique, à un « microscope » beaucoup plus sophistiqué que ceux qui ont permis à Alois Alzheimer de décrire la pathologie de la maladie il y a plus d’un siècle. « Alors qu’Alzheimer observait des plaques de protéines amyloïdes et des enchevêtrements de tau, notre ‘microscope’ à cellule unique nous révèle, cellule par cellule et gène par gène, des milliers de changements biologiques subtils mais significatifs en réponse à la pathologie », a-t-il expliqué.
Implications pour le traitement
L’association de ces informations avec l’état cognitif des patients permet de comprendre comment les réponses cellulaires sont liées à la perte cognitive ou à la résilience. « La pathologie peut précéder les symptômes cognitifs de dix à vingt ans avant que le déclin cognitif ne soit diagnostiqué. Si nous ne pouvons pas grand-chose pour la pathologie à ce stade, nous pouvons au moins essayer de protéger les voies cellulaires qui soutiennent la fonction cognitive », a ajouté Kellis.
Conclusion
L’étude, dirigée par Hansruedi Mathys, ancien postdoctorant au laboratoire de Tsai, et comprenant également Carles Boix et Leyla Akay, a analysé des échantillons provenant de l’Étude des Ordres Religieux et du Projet de Mémoire et de Vieillissement de l’Université Rush. Ces travaux ouvrent la voie à de nouvelles approches pour traiter la perte cognitive et à une meilleure compréhension des mécanismes sous-jacents à la maladie d’Alzheimer.
Vulnérabilité neuronale et Reelin dans la recherche sur Alzheimer
Les premiers signes de pathologie amyloïde et de perte neuronale dans la maladie d’Alzheimer se manifestent dans des zones du cerveau axées sur la mémoire, notamment l’hippocampe et le cortex entorhinal. Les chercheurs ont pu identifier une raison potentielle à cette situation dans ces régions, ainsi que dans d’autres parties du cortex cérébral.
Une catégorie de neurones excitateurs dans l’hippocampe, ainsi que quatre types dans le cortex entorhinal, étaient significativement moins présents chez les personnes atteintes d’Alzheimer par rapport à celles qui ne l’étaient pas.
Les individus présentant une diminution de ces cellules ont obtenu des résultats nettement moins bons lors des évaluations cognitives. De plus, de nombreux neurones vulnérables étaient interconnectés au sein d’un circuit neuronal commun. Fait tout aussi important, plusieurs de ces neurones exprimaient directement une protéine nommée Reelin ou étaient directement influencés par le signalement de Reelin.
Les résultats mettent donc en lumière des neurones particulièrement vulnérables, dont la perte est liée à une diminution des capacités cognitives, partageant un circuit neuronal et une voie moléculaire.
Tsai a souligné que Reelin a pris de l’importance dans la recherche sur Alzheimer grâce à une étude récente portant sur un homme en Colombie. Cet individu présentait une mutation rare dans le gène Reelin, entraînant une activité accrue de la protéine, et il a pu maintenir une bonne santé cognitive à un âge avancé, malgré une forte prédisposition familiale à l’Alzheimer précoce.
La nouvelle étude révèle que la perte de neurones producteurs de Reelin est associée à un déclin cognitif. Cela pourrait indiquer que le cerveau tire des bénéfices de Reelin, mais que les neurones qui le produisent pourraient être perdus chez certains patients atteints d’Alzheimer.
« Nous pouvons envisager Reelin comme ayant un effet protecteur ou bénéfique, » a déclaré Akay. « Cependant, nous ne savons pas encore ce qu’il fait exactement ni comment il pourrait conférer de la résilience. »
Dans une analyse plus approfondie, les chercheurs ont également découvert que des sous-types de neurones inhibiteurs particulièrement vulnérables, identifiés dans une étude antérieure de ce groupe dans le cortex préfrontal, étaient également impliqués dans le signalement de Reelin, renforçant ainsi l’importance de cette molécule et de sa voie de signalement.
Pour valider leurs résultats, l’équipe a examiné directement des échantillons de tissus cérébraux humains ainsi que des cerveaux de deux types de souris modèles d’Alzheimer. Ces expériences ont également révélé une réduction des neurones positifs pour Reelin dans le cortex entorhinal des humains et des souris.
Résilience cognitive liée au métabolisme de la choline dans les astrocytes
Pour identifier les facteurs susceptibles de préserver la cognition malgré la pathologie, l’équipe a analysé quels gènes, dans quelles cellules et dans quelles régions, étaient le plus étroitement associés à la résilience cognitive, définie comme une fonction cognitive résiduelle supérieure à la perte cognitive typique attendue compte tenu de la pathologie observée.
Leur analyse a révélé une réponse surprenante et spécifique : dans plusieurs régions cérébrales, les astrocytes exprimant des gènes liés à l’activité antioxydante, au métabolisme de la choline et à la biosynthèse des polyamines étaient significativement associés à une cognition soutenue, même en présence de niveaux élevés de tau et d’amyloïde.
Ces résultats renforcent des recherches antérieures menées par Tsai et Susan Lundqvist, qui avaient montré qu’un supplément alimentaire de choline aidait les astrocytes à faire face à la dérégulation des lipides causée par le gène de risque majeur d’Alzheimer, la variante APOE4.
Les résultats concernant les antioxydants ont également mis en lumière une molécule disponible en tant que supplément alimentaire, la spermidine, qui pourrait avoir des propriétés anti-inflammatoires, bien qu’un lien causal doive encore être établi.
Comme précédemment, l’équipe a dépassé les prévisions issues de l’analyse d’expression des ARN unicellulaires pour faire des observations directes dans les tissus cérébraux. Les échantillons provenant d’individus cognitivement résilients ont effectivement montré une expression accrue de plusieurs gènes exprimés par les astrocytes, prédits comme étant associés à la résilience cognitive.
Nouvelle méthode d’analyse et ensemble de données ouvert
Pour analyser les vastes quantités de données unicellulaires, les chercheurs ont développé une nouvelle méthodologie robuste basée sur des groupes de gènes exprimés de manière coordonnée (appelés « modules de gènes »), exploitant ainsi les motifs de corrélation d’expression entre des gènes fonctionnellement liés dans le même module.
« En théorie, les 1,3 million de cellules que nous avons examinées pourraient utiliser leurs 20 000 gènes dans un nombre astronomique de combinaisons différentes, » explique Kellis. « En pratique, cependant, nous observons un sous-ensemble beaucoup plus restreint de changements coordonnés. Reconnaître ces motifs coordonnés nous permet d’inférer des changements beaucoup plus robustes, car ils reposent sur plusieurs gènes dans le même module fonctionnellement connecté. »
Il a proposé cette analogie : Bien que les humains possèdent de nombreuses articulations leur permettant de se mouvoir de manière variée, dans la réalité, ils effectuent beaucoup moins de mouvements coordonnés, tels que marcher, courir ou danser. La nouvelle méthode permet aux scientifiques d’identifier ces programmes d’expression génique coordonnée en tant que groupe.
Bien que les laboratoires de Kellis et Tsai aient déjà rapporté plusieurs résultats remarquables issus de l’ensemble de données, les chercheurs estiment que de nombreuses découvertes potentiellement significatives restent à explorer dans cette mine d’informations. Pour faciliter ces découvertes, l’équipe a mis à disposition des outils d’analyse et de visualisation pratiques, accompagnés des données sur le site de Kellis.
« Cet ensemble de données est d’une richesse incroyable. Nous nous sommes concentrés sur quelques aspects saillants que nous jugeons très intéressants, mais nous n’avons en aucun cas épuisé les possibilités d’apprentissage offertes par cet ensemble de données, » a déclaré Kellis. « Nous anticipons encore de nombreuses découvertes à venir et espérons que de jeunes chercheurs (de tous âges) s’y plongeront et nous surprendront avec de nouvelles perspectives. »
À l’avenir, Kellis a indiqué que les chercheurs étudient le circuit de contrôle associé aux gènes exprimés différemment, afin de comprendre les variantes génétiques, les régulateurs et d’autres facteurs moteurs qui peuvent être modulés pour inverser les circuits de la maladie à travers différentes régions du cerveau, types cellulaires et stades de la maladie.
Informations complémentaires : Manolis Kellis, Dissection multirégionale à cellule unique de la maladie d’Alzheimer, Nature (2024). DOI : 10.1038/s41586-024-07606-7. www.nature.com/articles/s41586-024-07606-7
Citation : Étude à travers plusieurs régions cérébrales discernant les facteurs de vulnérabilité et de résilience à Alzheimer (2024, 24 juillet) récupéré le 1er août 2024 depuis https://medicalxpress.com/news/2024-07-multiple-brain-regions-discerns-alzheimer.html
Ce document est protégé par des droits d’auteur. À part toute utilisation équitable à des fins d’étude ou de recherche personnelle, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre informatif uniquement.
Général
Anker SOLIX dévoile la Solarbank 2 AC : la nouvelle ère du stockage d’énergie ultra-compatible !
Découvrez le Solarbank 2 AC, une véritable révolution dans le domaine de l’énergie solaire ! Grâce à ses batteries au phosphate de fer lithium, ce système s’adapte parfaitement à vos besoins. Avec une puissance impressionnante de 2400 watts et la possibilité d’ajouter jusqu’à cinq batteries supplémentaires, il assure un stockage optimal. Sa compatibilité avec le compteur Anker SOLIX Smart favorise une gestion intelligente de votre consommation énergétique. Ne ratez pas l’offre spéciale « early bird », disponible dès maintenant pour seulement 999 euros ! Saisissez cette chance unique !

Le Solarbank 2 AC : Une Révolution dans le Stockage Énergétique
Batteries au Lithium Fer Phosphate
Le Solarbank 2 AC se démarque par l’utilisation de batteries au lithium fer phosphate (LFP), reconnues pour leur sécurité et leur efficacité. Ce modèle est particulièrement innovant grâce à son système de couplage alternatif, qui lui permet de s’adapter facilement à divers systèmes solaires déjà en place.Que ce soit pour des installations sur toiture, des systèmes solaires compacts pour balcons ou d’autres configurations réduites, il peut fonctionner avec un micro-onduleur de 800 Watts.
Capacité et flexibilité Énergétique
Avec une capacité maximale d’injection dans le réseau domestique atteignant 1200 watts,le Solarbank 2 AC peut être associé à deux régulateurs solaires MPPT. Cela ouvre la possibilité d’ajouter jusqu’à 1200 watts supplémentaires via des panneaux solaires additionnels, portant ainsi la puissance totale à un impressionnant 2400 watts. Pour les utilisateurs nécessitant davantage de stockage énergétique, il est possible d’intégrer jusqu’à cinq batteries supplémentaires de 1,6 kilowattheure chacune, augmentant la capacité totale à 9,6 kilowattheures.
Intégration dans un Écosystème Intelligent
Le Solarbank 2 AC s’intègre parfaitement dans un écosystème énergétique intelligent grâce à sa compatibilité avec le compteur Anker SOLIX Smart et les prises intelligentes proposées par Anker. cette fonctionnalité permet une gestion optimisée de la consommation électrique tout en réduisant les pertes énergétiques inutiles. De plus, Anker SOLIX prévoit d’étendre cette compatibilité aux dispositifs Shelly.
Durabilité et Résistance aux Intempéries
Anker SOLIX met également l’accent sur la longévité du Solarbank 2 AC. Conçu pour supporter au moins 6000 cycles de charge, cet appareil a une durée de vie estimée dépassant quinze ans. Il est accompagné d’une garantie fabricant décennale et possède une certification IP65 qui assure sa résistance face aux intempéries tout en étant capable de fonctionner dans des températures variant entre -20 °C et +55 °C.
Disponibilité et Offres Promotionnelles
Le solarbank 2 AC est disponible sur le site officiel d’Anker SOLIX ainsi que sur Amazon au prix standard de 1299 euros. Cependant, une offre promotionnelle « early bird » sera active du 20 janvier au 23 février 2025, permettant aux acheteurs intéressés d’acquérir cet appareil dès 999 euros ! Cette promotion inclut également un compteur Anker SOLIX Smart offert pour chaque commande passée durant cette période spéciale.
le Solarbank 2 AC représente une avancée significative dans le domaine du stockage énergétique domestique grâce à ses caractéristiques techniques avancées et son engagement envers la durabilité environnementale.
Business
Une formidable nouvelle pour les conducteurs de voitures électriques !
Excellente nouvelle pour les conducteurs de véhicules électriques ! La recharge gratuite sur le lieu de travail sera exonérée d’impôts jusqu’en 2025. Annoncée par le ministère de l’Économie, cette mesure incitative, en place depuis 2020, s’inscrit dans une dynamique de croissance impressionnante avec une progression annuelle moyenne de 35%. Les entreprises peuvent ainsi offrir des bornes de recharge sans impact fiscal, stimulant la transition écologique. Reste à savoir si cela suffira à convaincre les entreprises hésitantes et à propulser l’électrification des flottes professionnelles vers un avenir durable.

Technologie
Recharge Électrique au Bureau : Une Exonération Fiscale Renouvelée
Les détenteurs de véhicules électriques et leurs employeurs peuvent se réjouir : la possibilité d’effectuer des recharges gratuites sur le lieu de travail sera exonérée d’impôts jusqu’en 2025. Cette décision, annoncée par le ministère des Finances, prolonge une initiative lancée en 2020 pour encourager l’adoption des véhicules électriques dans les entreprises.
Un Secteur en Croissance Dynamique
Cette prolongation intervient à un moment clé, alors que le marché des voitures électriques continue d’afficher une croissance remarquable. Entre 2020 et 2022, la progression annuelle moyenne a atteint 35%. En 2023, les particuliers représentent désormais 84% des acquisitions de véhicules électriques, contre seulement 68% en 2018.
Concrètement,cette mesure permet aux sociétés d’installer gratuitement des bornes de recharge pour leurs employés sans impact fiscal. Les frais liés à l’électricité pour ces recharges ne seront pas pris en compte dans le calcul des avantages en nature. De plus, un abattement de 50% sur ces avantages est maintenu avec un plafond révisé à environ 2000 euros pour l’année prochaine.
Accélération Vers une Mobilité Électrique
Cette initiative fait partie d’une stratégie globale visant à promouvoir l’électrification du parc automobile français. Cependant, les grandes entreprises rencontrent encore des difficultés pour atteindre leurs objectifs ; seulement 8% des nouveaux véhicules immatriculés par ces entités étaient électriques en 2023. Ces incitations fiscales pourraient néanmoins inciter davantage d’employeurs à franchir le pas.Cependant, plusieurs défis demeurent concernant les infrastructures nécessaires au chargement ainsi que sur l’autonomie des véhicules et les perceptions parmi les employés. Par ailleurs, la réduction progressive du bonus écologique pour les utilitaires et sa diminution pour les particuliers pourraient freiner cet élan vers une adoption plus large.
Avenir Prometteur Pour La Mobilité Électrique
Malgré ces obstacles potentiels, il existe un optimisme quant au futur de la mobilité électrique dans le milieu professionnel. Les avancées technologiques continues ainsi qu’un engagement croissant envers la durabilité devraient continuer à favoriser cette tendance vers une adoption accrue des véhicules écologiques.
En maintenant ces mesures fiscales avantageuses jusqu’en 2025 et au-delà, le gouvernement délivre un message fort soutenant la transition écologique dans le secteur du transport. Reste maintenant à voir si cela suffira réellement à convaincre certaines entreprises hésitantes et si cela permettra d’accélérer significativement l’électrification de leurs flottes professionnelles dans un avenir proche.
Divertissement
« À la rencontre d’un Hugo : une aventure inattendue »
Le prénom, un véritable reflet de notre identité, peut être à la fois lourd à porter et source de fierté. Dans cette chronique fascinante, le réalisateur Hugo David nous plonge dans son expérience avec un prénom très répandu. Né en 2000, il se retrouve entouré d’autres Hugo, ce qui l’amène à adopter un alias : Hugo D.. Comment ce choix a-t-il influencé son parcours ? Explorez les nuances et les histoires derrière nos prénoms et découvrez comment ils façonnent nos vies dès l’enfance jusqu’à l’âge adulte !

Les Prénoms : Un Voyage au Cœur de l’Identité
Le Rôle Crucial des Prénoms dans nos Existences
Chaque personne possède un prénom, qu’il soit courant ou singulier, et ce dernier peut engendrer à la fois fierté et embarras. Cet article explore la signification profonde et l’influence des prénoms sur notre vie quotidienne. Le réalisateur Hugo David partage son vécu avec un prénom qui a connu une forte popularité durant sa jeunesse.
une Naissance Sous le Signe de la Célébrité
Hugo David est né en 2000 à Tours, une époque où le prénom Hugo était en plein essor. Ses parents, Caroline et Rodolphe, avaient envisagé d’autres choix comme Enzo, également très en vogue à cette période. « Je pense que mes parents ont opté pour un prénom parmi les plus répandus en France plutôt qu’en hommage à Victor Hugo », confie-t-il.
Une Enfance Entourée d’Autres « Hugo »
Dès son plus jeune âge, Hugo se retrouve entouré d’autres enfants portant le même nom. Selon les statistiques de l’Insee,7 694 garçons ont été prénommés Hugo en 2000,faisant de ce prénom le quatrième plus populaire cette année-là. À l’école primaire,il côtoie plusieurs camarades appelés Thibault et autres prénoms similaires. Pour éviter toute confusion lors des appels en classe, les enseignants ajoutent souvent la première lettre du nom de famille après le prénom : ainsi devient-il rapidement « Hugo D. », un surnom auquel il s’habitue sans arduousé.
Pensées sur l’Identité Associée au Prénom
Le choix d’un prénom peut avoir un impact significatif sur notre identité personnelle tout au long de notre existence. Que ce soit pour se distinguer ou pour s’intégrer dans un groupe social spécifique, chaque individu développe une relation particulière avec son propre nom.
les prénoms ne sont pas simplement des désignations ; ils portent avec eux des récits et influencent nos interactions sociales depuis notre enfance jusqu’à l’âge adulte.
-

 Business1 an ago
Business1 an agoComment lutter efficacement contre le financement du terrorisme au Nigeria : le point de vue du directeur de la NFIU
-
 Général2 ans ago
Général2 ans agoX (anciennement Twitter) permet enfin de trier les réponses sur iPhone !
-

 Technologie1 an ago
Technologie1 an agoTikTok revient en force aux États-Unis, mais pas sur l’App Store !
-

 Général1 an ago
Général1 an agoAnker SOLIX dévoile la Solarbank 2 AC : la nouvelle ère du stockage d’énergie ultra-compatible !
-

 Général1 an ago
Général1 an agoLa Gazelle de Val (405) : La Star Incontournable du Quinté d’Aujourd’hui !
-

 Sport1 an ago
Sport1 an agoSaisissez les opportunités en or ce lundi 20 janvier 2025 !
-

 Business1 an ago
Business1 an agoUne formidable nouvelle pour les conducteurs de voitures électriques !
-

 Science et nature1 an ago
Science et nature1 an agoLes meilleures offres du MacBook Pro ce mois-ci !