Santé et médecine
Découverte Étonnante : Des Scientifiques du MIT Révèlent les Risques Potentiels de Cancer Liés au Jeûne
Des chercheurs du MIT ont révélé que les régimes hypocaloriques et le jeûne intermittent favorisent la régénération des cellules souches intestinales, essentielles pour la guérison. Cependant, cette régénération accrue pourrait également augmenter le risque de cancer si des mutations surviennent pendant la phase de ré-alimentation. En étudiant des souris, ils ont identifié un cheminement qui active cette régénération, mais attention : trop de régénération peut avoir des conséquences indésirables. Un équilibre délicat entre jeûne et alimentation est donc crucial pour notre santé intestinale.

Le jeûne intermittent et la santé intestinale : Une étude révélatrice

Les découvertes des chercheurs du MIT sur le jeûne
Des chercheurs du Massachusetts Institute of Technology (MIT) ont mis en lumière que le jeûne favorise la régénération et la guérison des cellules souches intestinales chez les souris, tout en augmentant le risque de cancer.
Les régimes hypocaloriques et le jeûne intermittent sont associés à de nombreux bienfaits pour la santé, notamment le retardement de l’apparition de certaines maladies liées à l’âge et l’augmentation de l’espérance de vie, tant chez les humains que chez d’autres organismes.
Des mécanismes complexes sous-tendent ce phénomène. Des recherches antérieures du MIT ont démontré que le jeûne stimule les capacités régénératrices des cellules souches intestinales, facilitant ainsi la récupération de l’intestin après des blessures ou des inflammations.
Une étude révélatrice sur la régénération cellulaire
Dans une étude récente, les chercheurs du MIT ont identifié le cheminement qui permet cette régénération accrue, activé lorsque les souris commencent à se ré-alimenter après une période de jeûne. Cependant, ils ont également découvert un inconvénient : lorsque des mutations cancéreuses se produisent durant cette période de régénération, les souris sont plus susceptibles de développer des tumeurs intestinales à un stade précoce.
« Avoir une activité accrue des cellules souches est bénéfique pour la régénération, mais un excès au fil du temps peut avoir des conséquences moins favorables », explique Omer Yilmaz, professeur associé de biologie au MIT et auteur principal de l’étude.
Yilmaz souligne que des études supplémentaires sont nécessaires avant de tirer des conclusions sur l’effet du jeûne chez les humains. « Nous avons encore beaucoup à apprendre, mais il est intéressant de noter que le fait d’être en état de jeûne ou de ré-alimentation lors de l’exposition à un mutagène peut avoir un impact profond sur la probabilité de développer un cancer dans ces modèles murins bien définis », ajoute-t-il.
Les mécanismes de la régénération
Depuis plusieurs années, le laboratoire de Yilmaz étudie l’impact du jeûne et des régimes hypocaloriques sur la santé intestinale. Dans une étude de 2018, son équipe a révélé que pendant le jeûne, les cellules souches intestinales commencent à utiliser des lipides comme source d’énergie, plutôt que des glucides, ce qui entraîne une augmentation significative de leur capacité régénératrice.
Cependant, des questions demeuraient : comment le jeûne déclenche-t-il cette augmentation de la capacité régénératrice, et quand commence cette régénération ?
Dans leur nouvelle étude, les chercheurs ont constaté que la régénération des cellules souches est inhibée pendant le jeûne, mais qu’elle augmente considérablement durant la période de ré-alimentation. Ils ont suivi trois groupes de souris : un groupe ayant jeûné pendant 24 heures, un autre ayant jeûné pendant 24 heures puis autorisé à manger librement pendant une période de ré-alimentation de 24 heures, et un groupe témoin ayant mangé sans restriction tout au long de l’expérience.
Les chercheurs ont analysé la capacité de prolifération des cellules souches intestinales à différents moments et ont découvert que ces cellules montraient les niveaux les plus élevés de prolifération à la fin de la période de ré-alimentation de 24 heures, surpassant même celles des souris n’ayant pas jeûné.
« Nous pensons que le jeûne et la ré-alimentation représentent deux états distincts », déclare Imada. « Dans l’état de jeûne, la capacité des cellules à utiliser des lipides et des acides gras comme source d’énergie leur permet de survivre lorsque les nutriments sont rares. Ensuite, c’est l’état de ré-alimentation post-jeûne qui stimule réellement la régénération. Lorsque les nutriments deviennent disponibles, ces cellules souches et progénitrices activent des programmes qui leur permettent de construire une masse cellulaire et de repeupler la muqueuse intestinale. »
Les risques associés à une régénération excessive
Les chercheurs ont également découvert que lorsque les cellules souches sont dans cet état hautement régénératif, elles sont plus susceptibles de devenir cancéreuses. Les cellules souches intestinales sont parmi les cellules les plus actives en division dans le corps, car elles aident la muqueuse intestinale à se renouveler complètement tous les cinq à dix jours. En raison de leur fréquence de division, ces cellules souches sont la source la plus courante de cellules précancéreuses dans l’intestin.
Dans cette étude, les chercheurs ont constaté que si un gène cancérigène était activé chez les souris durant la phase de ré-alimentation, elles étaient beaucoup plus susceptibles de développer des polypes précancéreux que si le gène était activé pendant l’état de jeûne. Les mutations liées au cancer survenues durant la phase de ré-alimentation étaient également beaucoup plus susceptibles de produire des polypes que celles survenues chez des souris n’ayant pas suivi le cycle de jeûne et de ré-alimentation.
« Je tiens à souligner que tout cela a été réalisé chez des souris, en utilisant des mutations cancéreuses très bien définies. Chez les humains, la situation sera beaucoup plus complexe », précise Yilmaz. « Mais cela nous amène à la notion suivante : le jeûne est très bénéfique pour la santé, mais si vous êtes malchanceux et que vous vous ré-alimentez après un jeûne tout en étant exposé à un mutagène, comme un steak carbonisé, vous pourriez en fait augmenter vos chances de développer une lésion pouvant évoluer vers un cancer. »
Yilmaz a également noté que les bénéfices régénérateurs du jeûne pourraient être significatifs pour les personnes subissant un traitement par radiothérapie, qui peut endommager la muqueuse intestinale, ou d’autres types de blessures intestinales. Son laboratoire étudie actuellement si des suppléments de polyamines pourraient aider à stimuler ce type de régénération, sans nécessiter de jeûne.
Cette recherche a été partiellement financée par une bourse Pew-Stewart Trust Scholar, le Marble Center for Cancer Nanomedicine, le projet Bridge du Koch Institute-Dana Farber/Harvard Cancer Center, et l’Initiative sur les cellules souches du MIT.
Général
Le Rotary investit 2 millions de dollars pour la santé maternelle : le président de la Fondation en visite au Nigeria pour explorer de nouvelles opportunités
Erreur 403 : Accès refusé !
Vous êtes face à un mur numérique. Impossible d’accéder à ce document, et la frustration monte. Que faire dans ces moments-là ? Ne paniquez pas ! Voici quelques solutions simples :
- Cliquez sur « Recharger la page »
- Passez à la page précédente
- Retournez à l’accueil
N’oubliez pas, chaque obstacle est une opportunité d’explorer de nouvelles voies !

Erreur de Serveur : Accès Refusé
Vous n’avez pas l’autorisation d’accéder à ce document.
Voici quelques actions possibles :
Rafraîchir la page
Retourner à la page précédente
Accéder à la page d’accueil
Santé et médecine
Les refuges d’Ottawa : Dîners festifs et cadeaux pour les résidents pendant les fêtes !
Le jour de Noël, les Pasteurs de la Bonne Espérance ont accueilli des centaines de personnes pour un repas festif chaleureux. Azery Sharrons, un homme de 70 ans vivant au refuge, a exprimé sa gratitude pour ce repas qui lui rappelle des souvenirs d’enfance. Husa Delice, un bénévole dévoué depuis 2022, a souligné l’importance de cette communauté où les sourires et la chaleur humaine règnent. Ce Noël n’était pas seulement une fête; c’était une occasion d’unir ceux qui en ont besoin et d’apporter un peu de réconfort dans leurs vies difficiles.

Célébrations de Noël au Refuge des Bons Samaritains
un repas chaleureux pour les plus démunis
Le jour de Noël, le Refuge des Bons samaritains a accueilli un grand nombre de personnes pour un repas fait maison. Les organisateurs s’attendaient à servir plusieurs centaines de convives tout au long de la journée.
L’engagement des bénévoles
Husa Delice, bénévole depuis 2022, a partagé son expérience en disant que cet endroit était « merveilleux » et lui avait permis de rencontrer des gens formidables. Il a remarqué que les membres de la communauté étaient »heureux » et « sourire aux lèvres ».
Une atmosphère conviviale malgré le froid
Delice a souligné l’importance d’offrir chaleur et réconfort aux personnes dans le besoin pendant cette période froide. Azery Sharrons, un homme âgé de 70 ans vivant dans une zone d’accueil du refuge, a exprimé sa gratitude pour le repas copieux qui rappelait les traditions festives.
Activités post-Noël au refuge
Le lendemain du jour de Noël, le refuge prévoit d’accueillir un groupe de chanteurs qui viendront égayer l’après-midi avec des chants traditionnels. Des dons tels que vêtements chauds et produits d’hygiène seront également distribués aux visiteurs.
Besoins matériels essentiels
Les dons comme tasses, assiettes et couverts sont cruciaux pour la cuisine communautaire. De plus, les couvertures et oreillers sont très appréciés par ceux qui séjournent au refuge.
Élargissement des festivités
En parallèle à ces activités sur leur site principal rue Murray, l’équipe du Refuge des Bons Samaritains s’est rendue dans cinq résidences offrant un logement soutenu afin d’y servir également le dîner traditionnel ainsi que distribuer des cadeaux.
Préparatifs minutieux en cuisine
Peter Gareau, responsable du service alimentaire au refuge, a expliqué qu’une préparation intensive est nécessaire avant Noël.Bien qu’il ait initialement craint ne pas avoir assez de dindes à cause du nombre élevé attendu, il a été soulagé par la générosité locale qui lui a permis d’obtenir suffisamment pour nourrir tous les invités durant toute la semaine.
Gareau souligne aussi que ces repas festifs peuvent raviver chez certains clients des souvenirs heureux liés à leur enfance : « Personne ne choisit ce mode de vie », dit-il en espérant que cela puisse inciter certains à participer aux programmes offerts par l’établissement.
Autres initiatives communautaires
D’autres organisations ont également organisé leurs propres célébrations durant cette période festive.Cornerstone Housing for Women par exemple avait prévu une collecte communautaire permettant la création de 321 sacs-cadeaux destinés aux résidents en situation précaire.
Chris O’Gorman mentionne que ces gestes montrent clairement aux bénéficiaires qu’ils sont soutenus par leur communauté. En collaboration avec Restaurant 18, ils ont préparé plusieurs centaines de plats traditionnels pour ceux vivant dans leurs installations.
Dons inattendus
De son côté Peter Tilley, directeur général du Ottawa Mission (Mission d’Ottawa), raconte comment ils ont reçu plus de 200 dons provenant d’un groupe appelé Backpacks for the Homeless (Sacs à dos pour sans-abri). Ces paquets contenaient divers articles allant des chaussettes jusqu’à une carte-cadeau Tim Hortons.
Tilley ajoute qu’ils ont ouvert leur chapelle toute la journée afin que ceux qui se sentent seuls puissent regarder tranquillement quelques films classiques tout en profitant ainsi d’un moment réconfortant pendant cette période difficile.
Santé et médecine
Les étoiles de Downton Abbey : que sont-elles devenues depuis la fin de la série ?
Il y a presque neuf ans, Downton Abbey a tiré sa révérence sur ITV, mais l’héritage de cette série emblématique perdure. Grâce à deux films et un troisième en cours de tournage, les fans peuvent retrouver leurs personnages préférés. Hugh Bonneville, Michelle Dockery et Joanne Froggatt ont continué à briller sur nos écrans avec des rôles captivants. Découvrez ce que ces acteurs talentueux ont accompli depuis la fin de la série et comment ils ont évolué au fil des années. La magie de Downton Abbey n’est pas prête de s’éteindre !
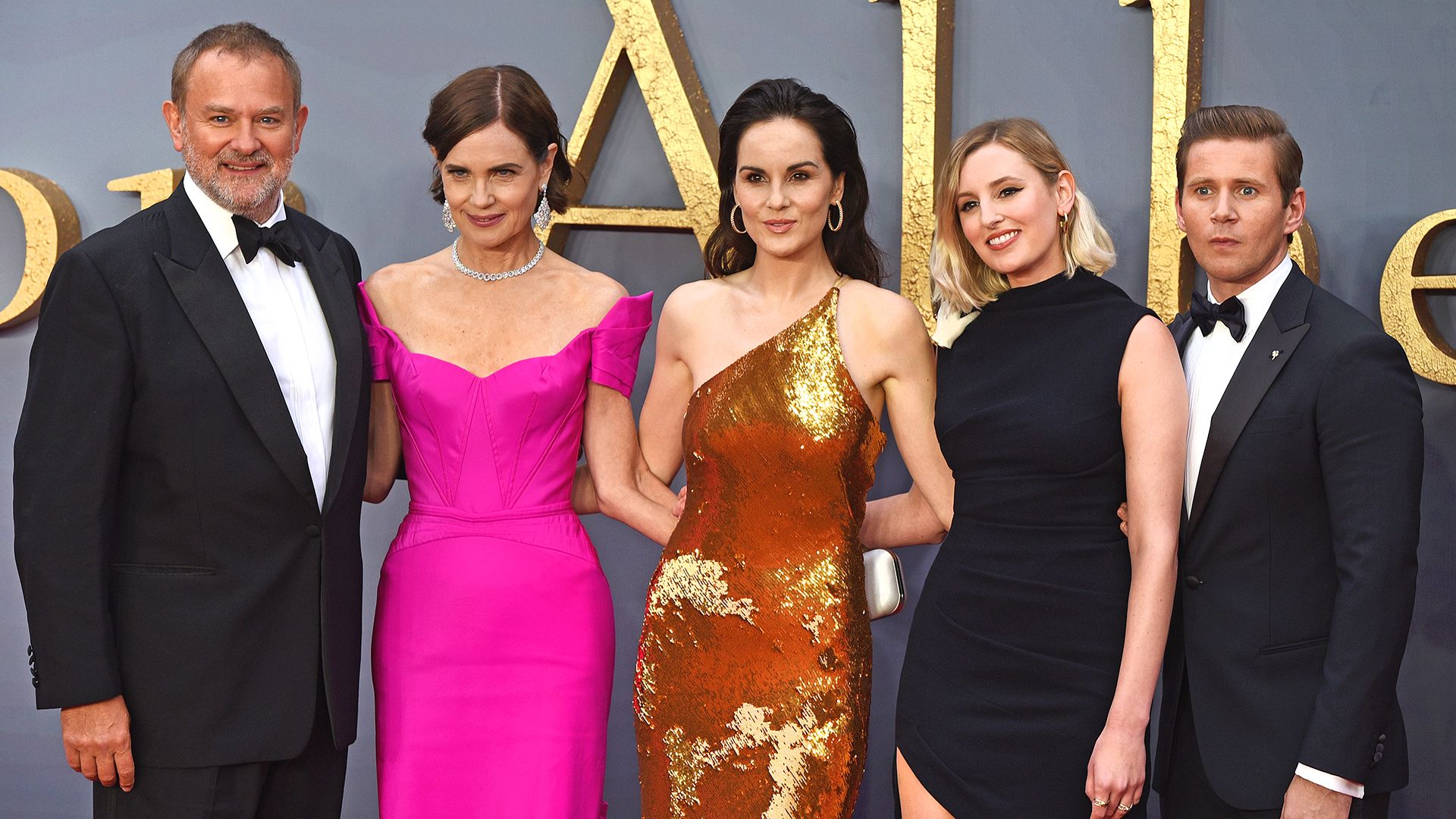
Medecine
Le temps passe vite, cela fait déjà neuf ans que la série Downton Abbey a pris fin sur ITV. Heureusement,cette franchise a donné naissance à deux films,et un troisième a été tourné cet été.
Depuis la conclusion de la série, nous avons eu le plaisir de voir les acteurs reprendre leurs rôles emblématiques, bien que quelques exceptions notables soient à signaler. Bien que nous n’ayons jamais vraiment dit adieu aux personnages, beaucoup de choses ont évolué pour Hugh Bonneville, Michelle Dockery, Joanne Froggatt et d’autres depuis leur passage dans l’émission. Voici un aperçu de ce qu’ils ont réalisé au cours des presque dix dernières années…
### Hugh Bonneville : Un parcours diversifié
Hugh Bonneville est reconnu pour son interprétation du comte Robert Crawley. Après la fin de Downton Abbey, il a continué à briller sur nos écrans dans la franchise Paddington, tout en décrochant des rôles dans des productions telles que I Came By (2022), Bank of Dave (2023) et le prochain film intitulé douglas is Cancelled, prévu pour 2024.
Cet été, Hugh a également participé au tournage du troisième film de la saga Downton Abbey qui n’a pas encore reçu son titre officiel.
### Michelle Dockery : Des rôles audacieux
Michelle Dockery continue d’incarner Lady Mary Crawley avec brio tout en s’attaquant à des rôles plus sombres et complexes. Parmi ses récentes apparitions télévisées figurent les séries godless (2017), Anatomy of a Scandal (2022) et le futur projet intitulé This Town, prévu pour 2024. Au cinéma, elle est apparue dans des films tels que The Gentlemen (2019), ainsi que dans les productions récentes comme Boy kills World (2023) et le très attendu film < em >Flight Risk (2024).
### Joanne Froggatt : Une carrière florissante
Joanne Froggatt est devenue célèbre grâce à son rôle d’Anna Bates dans la série acclamée ainsi que dans ses adaptations cinématographiques. Depuis l’arrêt du show en 2015, elle a obtenu des premiers rôles dans plusieurs séries télévisées telles que < em >Liar (2017-20), < em >Angela Black (2021) et < em >Breathtaking (prévu pour 2024). Récemment confirmée pour participer à une nouvelle série criminelle sans titre réalisée par Guy Ritchie aux côtés de Tom Hardy et Pierce brosnan.
### Jessica Brown findlay : Une étoile montante
Jessica Brown Findlay s’est fait connaître en incarnant Lady Sybil Branson avant de quitter Downton Abbey en 2012. Depuis lors, elle a joué dans plusieurs productions notables comme < em >jamaica Inn (2014), < em >Harlots (2017-19), ainsi qu’< emp >Brave New World (2020). Son dernier projet inclut une apparition prévue dans la série télévisée Playing Nice avec James Norton qui sortira le 5 janvier prochain.
### Laura Carmichael : L’artiste polyvalente
Laura Carmichael s’est illustrée par sa performance remarquable en tant qu’Edith Crawley. elle continue d’apporter sa touche unique au petit écran avec notamment son rôle marquant en tant que Margaret Pole dans < emp>The Spanish princess (2019-20) ou Agatha dans < emp>The Secrets She Keeps .
### Jim Carter : Un acteur prolifique
Jim Carter ne chôme pas ! après l’arrêt de Downton Abbey , il est apparu sur scène notamment avec sa participation remarquée à king Lear (2018) ou encore The Good Liar (2019). Plus récemment il était présent au cinéma avec The Sea Beast (2022) puis Wonka (prévu pour 2023).
### Penelope Wilton : Une carrière impressionnante
Penelope Wilton est célébrée pour son interprétation d’Isobel Gray .Sa filmographie comprend diverses œuvres telles que The Guernsey Literary and Potato Peel Pie Society(2018), After Life(2019-22 ), Operation Mincemeat( prévus cette année )et The Unlikely Pilgrimage of Harold fry( également prévu cette année ).
### Hommage à Dame Maggie Smith
Maggie Smith brillait sous les traits puissants de Violet Crawley , Comtesse douairière de Grantham . En plus d’avoir repris ce rôle iconique lors des films suivants,
Parmi ses nombreux projets récents figurent Sherlock Gnomes(18 ), A Boy Called Christmas(en21 )etThe Miracle Club(en23 ). Malheureusement,maggie nous a quittés le27 septembre dernierà l’âgede89 ans,soulevant une vagued’hommages émouvantsde lamisde Downtown.
-

 Business1 an ago
Business1 an agoComment lutter efficacement contre le financement du terrorisme au Nigeria : le point de vue du directeur de la NFIU
-
 Général2 ans ago
Général2 ans agoX (anciennement Twitter) permet enfin de trier les réponses sur iPhone !
-

 Technologie1 an ago
Technologie1 an agoTikTok revient en force aux États-Unis, mais pas sur l’App Store !
-

 Général1 an ago
Général1 an agoAnker SOLIX dévoile la Solarbank 2 AC : la nouvelle ère du stockage d’énergie ultra-compatible !
-

 Général1 an ago
Général1 an agoLa Gazelle de Val (405) : La Star Incontournable du Quinté d’Aujourd’hui !
-

 Sport1 an ago
Sport1 an agoSaisissez les opportunités en or ce lundi 20 janvier 2025 !
-

 Business1 an ago
Business1 an agoUne formidable nouvelle pour les conducteurs de voitures électriques !
-

 Science et nature1 an ago
Science et nature1 an agoLes meilleures offres du MacBook Pro ce mois-ci !